O impacto do THC e do CBD na esquizofrenia
Share
Antecedentes: Pessoas com esquizofrenia são mais propensas a desenvolver transtorno de uso de cannabis (CUD) e experimentar piores resultados com o uso. No entanto, como a cannabis é legalizada para uso médico e recreativo, há interesse em seu potencial terapêutico.
Objetivos: Conduzir uma revisão sistemática resumindo o desenho e os resultados de estudos controlados usando doses definidas de THC e CBD na esquizofrenia.
Método: Uma pesquisa por palavra-chave em oito bancos de dados de literatura on-line identificou 11 relatórios elegíveis.
Resultados:Um estudo controlado por placebo (13 pacientes estáveis sem CUD) descobriu que o THC intravenoso aumentou a psicose e piorou o aprendizado/lembrança. Dois relatórios de um estudo de ressonância magnética funcional (fMRI) de THC fumado ou oral em 12 pacientes abstinentes com esquizofrenia e CUD não encontraram nenhuma mudança nos sintomas e cognição, e uma melhora da função cerebral prejudicada em estado de repouso em áreas implicadas na função de recompensa e no padrão rede modo. Um estudo de 4 semanas em pacientes psicóticos agudos sem CUD (idade média de 30 anos) descobriu que 800 mg de CBD são igualmente eficazes para amisuprida na melhora da psicose e da cognição. Dois estudos de 6 semanas de aumento de antipsicóticos com CBD em pacientes ambulatoriais estáveis relataram resultados mistos: CBD 600 mg não foi mais eficaz que placebo; CBD 1.000 mg reduziu os sintomas em uma amostra que não excluiu o uso de cannabis e CUD.
Discussão: Existe uma heterogeneidade substancial entre os estudos quanto à dose, método de administração do medicamento, duração do tratamento, idade do paciente, se os pacientes com uso de cannabis/CUD foram incluídos ou excluídos e se os pacientes estavam usando medicação antipsicótica.
Conclusão: Não há evidências suficientes para um efeito de THC ou CBD nos sintomas, cognição e medidas de neuroimagem da função cerebral na esquizofrenia. No momento, a pesquisa não apóia a recomendação de cannabis medicinal (THC ou CBD) para o tratamento de pacientes com esquizofrenia. Pesquisas adicionais devem examinar o THC e o CBD na esquizofrenia com e sem CUD comórbido e considerar o papel do CBD na mitigação da exacerbação dos sintomas do THC.
Introdução
A esquizofrenia é um distúrbio crônico do neurodesenvolvimento experimentado por 0,5 a 1,0% da população em todo o mundo ( 1 , 2 ). Essa condição geralmente começa no final da adolescência ou início da idade adulta e inclui sintomas positivos, como alucinações, e sintomas negativos, como avolição. Deficiências cognitivas, como atenção e memória de trabalho, são características centrais da esquizofrenia, e uma capacidade prejudicada de antecipar recompensas também foi documentada ( 3 ). Ansiedade significativa é comum, embora não seja um sintoma central da esquizofrenia ( 4,5). Os transtornos por uso concomitante de substâncias são mais comuns em pessoas com esquizofrenia do que na população em geral, e a maconha é a droga ilícita mais comum usada por pessoas com essa condição ( 6 – 9 ). Até 43% das pessoas com esquizofrenia desenvolvem um transtorno por uso de cannabis (DCU) ( 10 – 13 ) em comparação com 6,3% na população em geral ( 14 ).
Curiosamente, estudos epidemiológicos demonstraram que o uso pesado de cannabis no início da adolescência está associado a um risco aumentado para o desenvolvimento de novos sintomas psicóticos e transtornos do espectro da esquizofrenia ( 15 – 19 ). Foi observada uma relação dose-resposta, com maior incidência de esquizofrenia encontrada em usuários pesados de cannabis em comparação com usuários leves ou não usuários ( 17 ). Além disso, entre as pessoas que têm um transtorno do espectro da esquizofrenia estabelecido, estudos observacionais mostraram que o uso recreativo de cannabis e o transtorno do uso de cannabis estão associados a sintomas piores e ao curso da doença ( 20 – 23). Como delinearemos mais abaixo, examinar os efeitos do THC e do CBD, sozinhos e juntos, pode ajudar a entender melhor o mecanismo de ação dos efeitos da cannabis, a fisiopatologia da esquizofrenia e se existe algum papel terapêutico para esses componentes da cannabis em pessoas com esquizofrenia com e sem transtornos por uso de cannabis.
Cannabis é um gênero de plantas com várias espécies contendo mais de 100 tipos de canabinóides. As espécies são criadas para promover níveis variados de canabinóides, especialmente (–)- trans -Δ 9 -tetrahidrocanabinol (THC) e canabidiol (CBD), que têm efeitos diferentes. O THC é responsável pela “alta” intoxicante da cannabis e é provavelmente um componente da cannabis responsável pelo desenvolvimento de CUD em cerca de 10% dos usuários [para revisão, consulte (24) ] . Em contraste, o CBD não parece causar intoxicação, nem é reforçador ( 25 , 26 ).
Estudos laboratoriais controlados em participantes saudáveis demonstraram que a administração de THC resulta em sintomas psicóticos agudos e prejuízos cognitivos transitórios relacionados à dose, inclusive na memória de trabalho e no controle executivo da atenção, em até 50% dos indivíduos saudáveis ( 27 ), e para revisão , ver ( 28 ). Alguns estudos mostram um efeito de dose para psicose [por exemplo, ( 27 )]. O pré-tratamento com CBD demonstrou mitigar tais sintomas e deficiências induzidos pelo THC ( 29 – 32 ), mas não os efeitos positivos e de reforço ( 26 ). Notavelmente, o teor de THC na cannabis de rua típica aumentou de ~4% em 1995 para ~12% em 2014 ( 33), e a proporção de CBD para THC diminuiu para quase zero em muitas cepas, embora cepas com alto teor de CBD também estejam disponíveis ( 34 ). THC e CBD são usados para criar uma variedade de produtos de alta potência para venda, especialmente em locais onde a cannabis medicinal e recreativa é legal. Assim, a cannabis recreativa com alto teor de THC facilmente disponível tem um forte potencial para causar efeitos negativos.
Embora o uso recreativo de cannabis (supostamente rico em THC e baixo em CBD) tenha sido associado a piores resultados na esquizofrenia, vários relatos de casos sugeriram que o próprio CBD pode ser benéfico no tratamento da psicose ( 35 , 36 ). Um relatório transversal mais recente indicou que o uso de cannabis com alto teor de CBD foi associado a sintomas psicóticos significativamente menores em pacientes com esquizofrenia ( 32 ). Pesquisas usando modelos animais examinando as propriedades antipsicóticas do CBD determinaram que o CBD leva a respostas comportamentais semelhantes às respostas a um medicamento antipsicótico atípico ( 35 ), contribuindo para o interesse em testar o CBD quanto à sua capacidade de melhorar os sintomas em pacientes com esquizofrenia.
Como o Canadá e partes dos EUA legalizaram a cannabis para fins recreativos (16 estados a partir de 2021) ou médicos (12 estados a partir de 2021) ( 37 ), a produção e as vendas de cannabis dispararam e o público cada vez mais percebe a cannabis como útil em vez de do que prejudicial. Pesquisas recentes mostraram que quase metade dos americanos afirmaram acreditar que a cannabis pode aliviar a ansiedade e a depressão ( 38 ). Assim, em locais onde a maconha é legal para uso recreativo ou médico, muitas pessoas a procuram para tratar de problemas de saúde mental. Por exemplo, em um relatório dos EUA, mais de um terço das pessoas que usaram cannabis medicinal relataram usá-la para reduzir a ansiedade ( 39), e vários estudos canadenses relataram que a cannabis era amplamente usada para tratar ansiedade, depressão e sono ( 40 , 41 ), sintomas comuns em uma variedade de condições de saúde mental, incluindo transtornos psicóticos ( 42 ).
Assim, como as partes interessadas estão cada vez mais interessadas nos possíveis efeitos terapêuticos da cannabis, elas precisam de informações confiáveis sobre os efeitos do THC e do CBD, principalmente entre populações vulneráveis, como pessoas com esquizofrenia. Várias revisões anteriores abordaram os efeitos do THC ou CBD em pessoas com esquizofrenia ( 43 – 50 ). Procuramos fornecer uma revisão atualizada, bem como uma revisão detalhada e crítica da literatura, incluindo estudos de CBD e THC considerados em conjunto, bem como uma revisão crítica dos métodos de pesquisa, qualidade da pesquisa e direcionamento das evidências para cada um estudar ( 51), com foco em ensaios clínicos randomizados (RCTs), pois fornecem o mais alto nível de evidência. Esta revisão, portanto, fornece uma revisão das evidências dos potenciais benefícios e danos do THC e/ou CBD na esquizofrenia até o momento. Conduzimos uma revisão sistemática de estudos prospectivos e controlados publicados testando o impacto do THC e/ou CBD nos sintomas, cognição e medidas de neuroimagem da função cerebral em pessoas com transtornos do espectro da esquizofrenia.
Metodologia
Fonte de informação e pesquisa
Pesquisas bibliográficas usando PubMed/MEDLINE, PsycINFO, PsycARTICLES, CINAHL, EMBASE, Scopus, Cochrane e Academic One File foram realizadas para artigos em inglês publicados entre 1º de janeiro de 1970 e 15 de junho de 2021. Os termos de pesquisa incluíram: “canabidiol AND esquizo * ”; “canabidiol E psico * ”; “CBD E esquizo * ”; “CBD E psico * ”; “tetrahidrocanabinol E esquizo * ”; “tetraidrocanabinol E psico * ”; “THC E esquizo * ”; “THC E psicopata *.” Além disso, examinamos revisões científicas recentes revisadas por pares da literatura sobre canabinóides e psicose, bem como seções de referência de artigos obtidos na pesquisa de literatura on-line, para quaisquer outros artigos relevantes.
Critérios de inclusão e exclusão
Todos os estudos relatando RCTs prospectivos testando doses específicas de cannabis de planta inteira, CBD, THC ou ambos os compostos em comparação com placebo ou condição de controle com avaliações padronizadas de sintomas de psicose, cognição e/ou neuroimagem em humanos com transtornos do espectro da esquizofrenia foram considerados. Qualquer formulação de THC ou CBD comercialmente disponível ou sintética foi aceita, bem como qualquer via de administração por qualquer período de tempo. Idade, sexo e raça/etnia não foram incluídos nos critérios de seleção. Excluímos estudos transversais, estudos observacionais sem uma condição de controle, estudos que examinaram cannabis que não usou uma dose específica de THC e/ou CBD, CBD usado para doenças psiquiátricas que não esquizofrenia, artigos não escritos em inglês; estudos que não relatam pesquisas originais,
Avaliação da qualidade do estudo
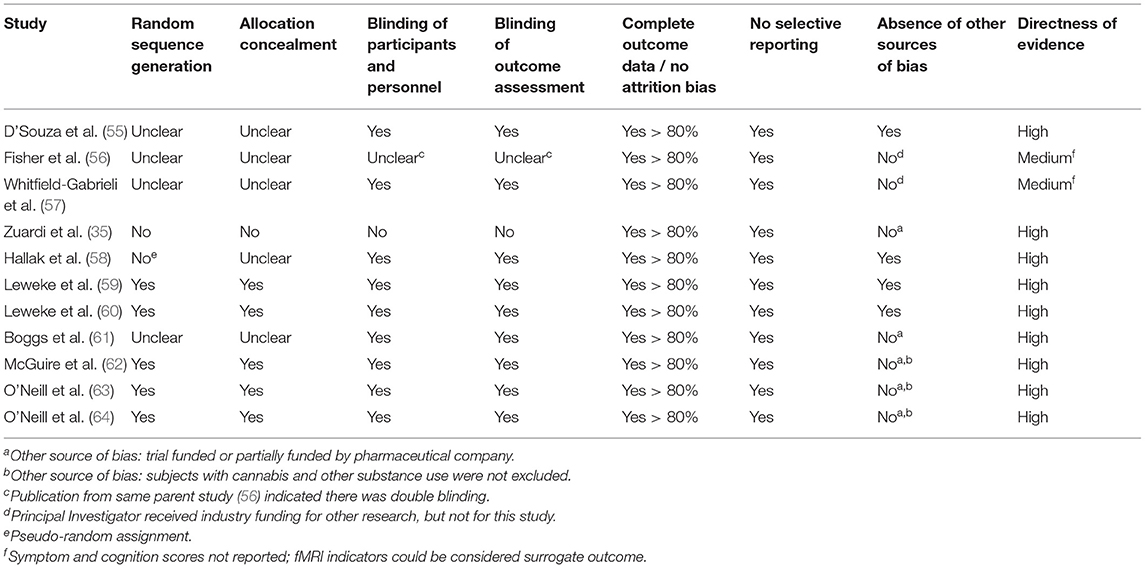
Depois que os estudos foram selecionados, realizamos uma avaliação da qualidade do estudo usando uma lista de verificação para a abordagem de "classificação de recomendação, avaliação, desenvolvimento e avaliação (GRADE" ( 51 ). O GRADE é um sistema de classificação transparente e amplamente utilizado para avaliar a qualidade da pesquisa e desenvolver resumos de evidências que forneçam uma abordagem sistemática para fazer recomendações de prática clínica ( 52 – 54 ) Usamos duas categorias: qualidade do estudo/risco de viés e objetividade/indireção da evidência.
Resultados
Seleção de estudo
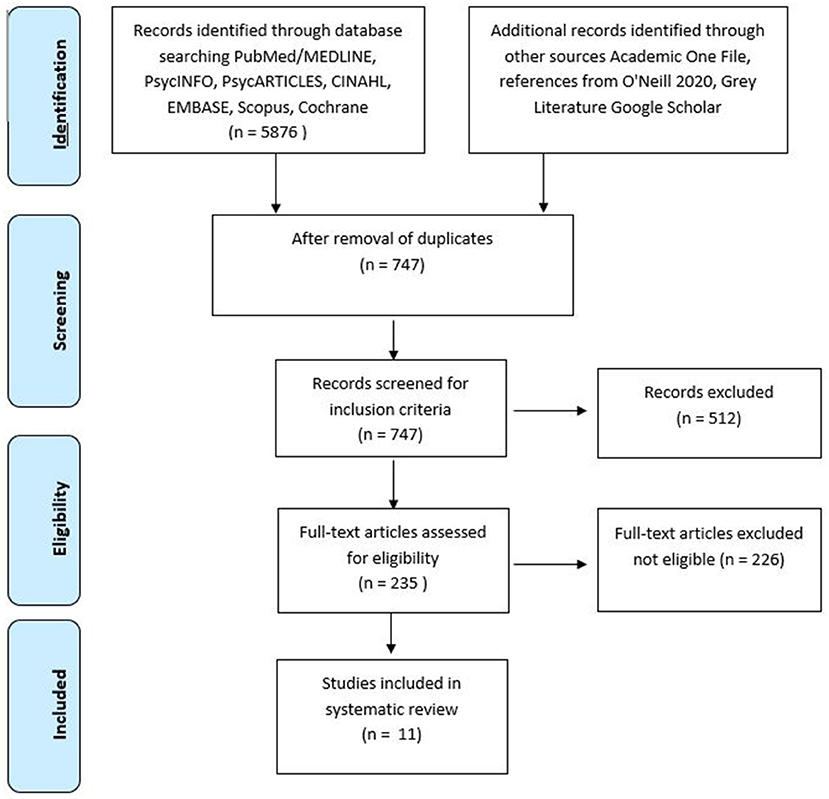
A pesquisa inicial rendeu 6.003 relatórios. Após a remoção de duplicatas, os estudos foram selecionados com base nos títulos, resultando na inclusão de 722 citações. Os resumos foram então triados, o que resultou na exclusão de 512 citações. Os artigos restantes (235) foram revisados para elegibilidade por dois autores (CNS e SA). Eventuais discordâncias foram mediadas por um terceiro revisor (MB). Um total de 226 artigos não se encaixaram nos critérios de inclusão, resultando em 11 artigos de texto completo que atenderam aos critérios de inclusão. As etapas de seleção são mostradas na Figura 1 .
Características do estudo
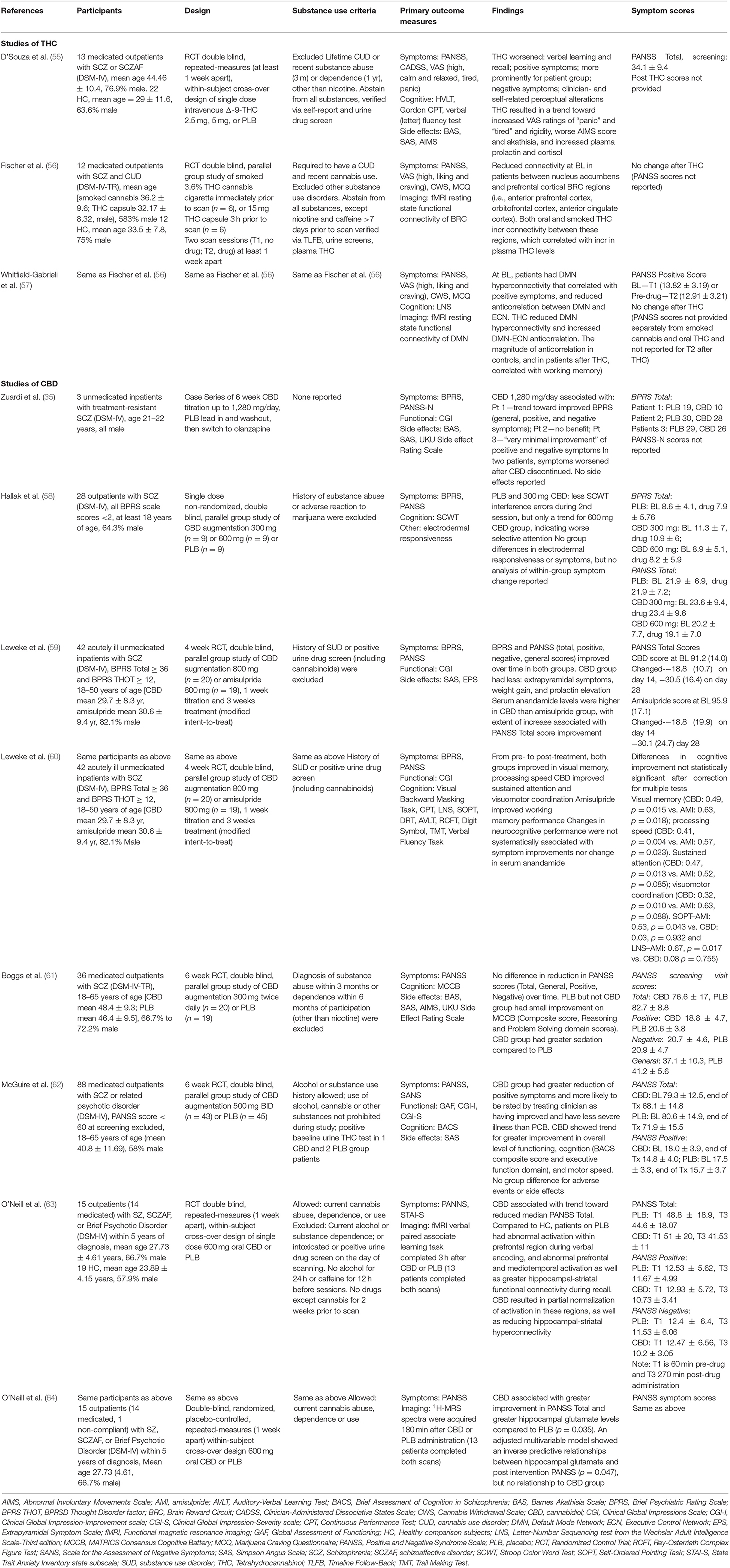
A Tabela 1 fornece as características dos nove estudos prospectivos controlados por placebo de cannabis, CBD e/ou THC. Esses estudos foram publicados entre 2005 e 2021 e empregaram uma variedade de métodos, descritos na tabela e abaixo.
Características dos estudos de CBD
Quatro RCTs (relatados em seis artigos) preencheram os critérios de inclusão/exclusão. Três foram estudos longitudinais de tratamento com duração de 4 a 6 semanas ( 59 , 61 , 62 ) e um foi um estudo laboratorial de dose única relatado em dois artigos que usaram ressonância magnética funcional (fMRI) ( 63 ) e espectroscopia de ressonância magnética de prótons ( 1H - MRS) ( 64 ). Também incluímos uma sessão única, não randomizada, um estudo balanceado avaliando a cognição ( 58 ) e uma série de casos de tratamento cruzado controlado por placebo de três pacientes ( 35 ). Quatro desses RCTs avaliaram CBD vs. placebo para potencialização antipsicótica ( 58 ,61 – 64 ), enquanto outro comparou o CBD à amissulprida em pacientes com doenças agudas sem antipsicóticos por pelo menos 3 dias, o que foi relatado em dois artigos ( 59 , 60 ).
Um total de 152 pacientes ambulatoriais estáveis e 45 pacientes psicóticos agudos internados com esquizofrenia esquizofreniforme ou transtorno psicótico breve foram examinados. Os tamanhos das amostras variaram de 15 ( 63 ) a 28 ( 58 ) nos estudos laboratoriais de dose única e de 36 a 88 nos ensaios clínicos longitudinais ( 59 , 61 , 62 ). Os estudos de CBD tiveram amostras de estudo e desenhos de estudo heterogêneos, que são revisados abaixo.
Em relação à demografia, vários estudos tiveram amostras de adultos jovens com idade média abaixo de 30 anos ( 35 , 59 , 60 , 63 , 64 ) e dois estudos relataram a idade média dos pacientes na faixa dos 40 anos. A maioria dos participantes (58-89%) era do sexo masculino. Enquanto a maioria dos participantes se identificou como branca/caucasiana em dois estudos ( 61 , 62 ), os outros quatro artigos não forneceram a raça/etnia de suas amostras.
Dois estudos incluíram pacientes ambulatoriais em uso de medicamentos que tinham doenças crônicas ( 58 , 61 , 62 ) e um estudo incluiu pacientes em uso de medicamentos que estavam dentro de 5 anos do início da doença ( 63 , 64 ). Dois estudos envolveram pacientes crônicos que eram pacientes psicóticos agudos internados no momento da participação ( 35 , 59 , 60 ), e esses pacientes iniciaram o teste de medicação antipsicótica. Um estudo parece ter incluído uma amostra mista de pacientes ambulatoriais com ou sem medicamentos antipsicóticos ( 58 ).
Três estudos excluíram participantes com uso de maconha, álcool e outras substâncias ou transtornos por uso de substâncias ( 58 – 61 ), mas apenas um usou triagens de drogas na urina como verificação neste processo ( 59 ). Dois estudos permitiram o uso de cannabis durante o julgamento ( 62 – 64 ). Um desses dois estudos excluiu pacientes que atendem aos critérios para diagnóstico atual de dependência de álcool ou substâncias ou triagem positiva para drogas, mas permitiu o uso atual de CUD e cannabis antes e durante o estudo ( 63 , 64 ). Um estudo não excluiu aqueles com histórico de transtorno por uso de álcool ou substâncias, e o uso de todas as substâncias foi permitido durante o estudo ( 62). A série de casos não forneceu informações relativas à inclusão/exclusão de pessoas com histórico de transtorno por uso de álcool ou substâncias ( 35 ). O uso de nicotina geralmente não foi excluído, mas apenas um estudo relatou o status de fumante ( 61 ).
A dose e a duração do tratamento com CBD variaram amplamente entre os estudos. A dose de CBD variou de 300 mg a 1.280 mg/dia. Três RCTs e a série de casos forneceram doses diárias durante 4 a 6 semanas ( 35 , 59 – 62 ). Dois administraram uma única dose ( 58 , 63 , 64 ).
As medidas de desfecho incluíram sintomas, efeitos colaterais, cognição, 1 H-MRS e ativação cerebral medida por fMRI. Os sintomas clínicos foram mais comumente avaliados usando a Escala Breve de Avaliação Psiquiátrica [BPRS ( 65 )] e a Escala de Sintomas Positivos e Negativos [PANSS ( 66 )]. Os efeitos do CBD nos sintomas clínicos foram relatados por cinco estudos ( 35 , 59 , 61 – 63 ). Os efeitos colaterais foram avaliados nesses mesmos cinco estudos. Os efeitos colaterais motores foram comumente avaliados usando medidas como a Escala de Acatisia de Barnes [BAS ( 67 )], Escala de Simpson Angus [SAS ( 68 )] e a Escala de Movimentos Involuntários Anormais [AIMS ( 69))]. A cognição foi avaliada em cinco estudos ( 58 , 60 – 63 ) com uma variedade de medidas, e três incluíram testes laboratoriais ( 59 , 60 , 62 , 63 ). Um estudo avaliou os efeitos do CBD em uma ativação de fMRI durante uma tarefa de aprendizagem e memória verbal ( 63 ) e 1 H-MRS para medir os níveis de glutamato no hipocampo esquerdo ( 64 ). Uma variedade de outras medidas foram usadas ocasionalmente, como peso ( 59 , 62 ) e condutância da pele ( 58 ).
Características dos estudos de THC
Apenas três publicações relatam os efeitos do THC entre pacientes com esquizofrenia ( 55 – 57 ); dois examinando diferentes análises de dados do mesmo estudo ( 56 , 57 ). Esses estudos incluíram um total de 25 pacientes ambulatoriais estáveis e medicados com esquizofrenia crônica, idade média dos pacientes 32,2 ( 57 ) e 44,5 ( 55 ). A proporção de homens variou de 58,3% ( 56 , 57 ) a 76,9% ( 55 ). A composição da raça variou, com a proporção identificada como caucasiana variando de 46% ( 55 ) a 100% ( 56 , 57 ).
Um estudo excluiu todos os transtornos por uso de substâncias, exceto nicotina e cafeína ( 55 ), enquanto o outro ( 56 , 57 ) incluiu explicitamente o CUD. Os participantes do estudo D'Souza ( 55) foram obrigados a se abster de bebidas com cafeína, álcool e substâncias ilícitas de 2 semanas antes do início do teste até a conclusão do estudo, verificada por auto-relato e triagem de drogas na urina. Em contraste, os estudos de Fisher e Whitfield-Gabrieli exigiam que os pacientes preenchessem os critérios para abuso e/ou dependência de cannabis e tivessem usado a substância no mês anterior. Os pacientes então se abstiveram de todas as substâncias, com reforços contingentes, exceto nicotina e cafeína por pelo menos 7 dias antes das sessões de teste, o que foi verificado usando o método Timeline Follow Back ( 70 ), triagens de drogas na urina e alterações no THC quantitativo na urina para garantir abstinência.
A dose de THC e a via de administração variaram nesses estudos. Um usou uma dose única de 2,5 mg e 5 mg de THC administrado por via intravenosa em diferentes sessões ( 55 ). Os pacientes dos estudos de Fisher et al. e Whitfield-Gabrieli et al. fumou uma dose única de cigarros com 3,6% de THC ou ingeriu 15 mg de THC oral em uma ocasião.
Todos os três estudos avaliaram os efeitos do THC nos sintomas usando o PANSS, bem como mudanças na sensação de “alto” e outros sintomas como “pânico” usando uma Escala Visual Analógica (VAS). Fischer et ai. e Whitfield-Gabrieli et al. também incluiu medidas formais de abstinência e fissura por cannabis. Os estudos incluíram medidas de cognição e dois relatórios usaram fMRI para avaliar a ativação cerebral durante um estado de repouso ( 56 , 57 , 63 ). Todos os estudos coletaram amostras de sangue para avaliar o THC plasmático, enquanto um também coletou cortisol e prolactina ( 55 ).
Resumos de estudo
Efeitos do THC na Esquizofrenia
Um ECR duplo-cego avaliou os efeitos do THC intravenoso 2,5 e 5 mg versus placebo em 13 pacientes ambulatoriais estáveis e abstinentes com esquizofrenia ou transtorno esquizoafetivo sem qualquer transtorno por uso de substância que estavam estáveis sob medicação antipsicótica. Os resultados foram comparados com 22 participantes saudáveis que completaram um protocolo semelhante ( 27). Os participantes receberam o medicamento do estudo em três sessões, separadas por pelo menos 1 semana. A abstinência de bebidas com cafeína, álcool e drogas ilícitas de 2 semanas foi exigida antes do início do teste até a conclusão do estudo, verificada por meio de autorrelato e exames de urina para drogas ilícitas. Os sintomas e testes cognitivos foram concluídos 10 e 30 minutos após a infusão, respectivamente. O THC resultou em piora dos sintomas positivos (80% dos pacientes tiveram piora da pontuação da subescala PANNS em pelo menos 3 pontos com a dose de 2,5 mg). A aprendizagem verbal e a recordação também pioraram, e essas mudanças foram mais proeminentes no grupo de pacientes em comparação com os participantes saudáveis. Os efeitos nos sintomas positivos não foram diferentes por dose, enquanto houve um efeito da dose no aprendizado e na recordação. O THC também piorou os sintomas negativos, alterações perceptivas auto-relacionadas pelo clínico e sintomas de movimento (AIMS e escores de acatisia). O THC aumentou a prolactina e o cortisol plasmáticos mais do que o placebo. A exigência de abstinência de fumar durante o dia do teste pode ter resultado na exacerbação dos sintomas associados à abstinência de nicotina.
Dois relatórios foram publicados a partir de um estudo avaliando o efeito de THC oral 15 mg ou THC fumado de um baseado NIDA de 3,6% nos sintomas, cognição e circuitos cerebrais usando fMRI ( 56 , 57). Doze pacientes ambulatoriais estáveis, tratados e abstinentes com esquizofrenia e CUD foram avaliados, em contraste com o estudo D'Souza, no qual o CUD foi excluído. Dependência de álcool e outros transtornos por uso de substâncias ilícitas foram excluídos. Os pacientes estavam abstinentes de substâncias, com exceção de nicotina e cafeína, por pelo menos 7 dias antes dos dias de ressonância magnética, verificados por auto-relato, triagem de drogas na urina e testes quantitativos três vezes por semana. Fumantes de tabaco fumaram um cigarro 90 minutos antes da varredura. Os pacientes completaram duas sessões de fMRI com pelo menos 1 semana de intervalo. A primeira sessão (basal) foi concluída sem manipulação farmacológica. Durante a segunda sessão (medicamentosa), os pacientes foram randomizados para fumar um cigarro de maconha com 3,6% de THC usando um dispositivo semelhante ao narguilé compatível com ressonância magnética imediatamente antes da varredura ( n= 6), ou ingerir uma cápsula de 15 mg de THC 3 h antes da varredura ( n = 6). Um grupo de 12 controles saudáveis também completou duas sessões de escaneamento.
Os resultados deste estudo foram publicados em dois relatórios. No primeiro relatório ( 56), no início do estudo, os pacientes mostraram conectividade funcional em estado de repouso reduzida entre a região de semente do núcleo accumbens bilateral (NAc) e regiões corticais pré-frontais envolvidas no processamento de recompensa (ou seja, córtex pré-frontal anterior, córtex orbitofrontal e córtex cingulado anterior ventral), bem como córtex dorsolateral pré-frontal e pré-motor, ínsula e giro para-hipocampal. Apenas uma região, dentro do córtex visual, apresentou maior conectividade com o NAc nos pacientes do que nos controles. Tanto o THC fumado quanto o oral aumentaram a conectividade entre as regiões accumbens e pré-frontal, com maior conectividade associada a níveis mais altos de THC plasmático na amostra combinada de pacientes (ou seja, cannabis fumada e THC oral). O THC não foi associado a alterações nos sintomas ou cognição, mas as pontuações não foram incluídas no artigo. O desejo e a abstinência de cannabis também não mudaram com THC versus placebo nesses participantes abstinentes, mas as pontuações também não foram relatadas. Além disso, nenhuma relação foi observada entre a conectividade e as avaliações dos pacientes de alto, gosto e desejo. Os autores interpretaram essas descobertas como consistentes com a hipótese de que o circuito de recompensa é interrompido na esquizofrenia e no CUD e que, ao melhorar essa interrupção, a dose baixa de THC pode ter o potencial de reduzir o uso de cannabis nessa população.
Em análises posteriores, Whitfield-Gabrieli et al. ( 57) examinou a conectividade da rede de modo padrão (DMN) nos 12 pacientes descritos acima. No início do estudo, em relação ao grupo saudável, os pacientes apresentaram hiperconectividade DMN que se correlacionou com maior gravidade dos sintomas positivos de PANSS, bem como anticorrelação reduzida entre o DMN e a rede de controle executivo (ECN). O THC resultou na redução dessa hiperconectividade e aumentou a anticorrelação DMN-ECN. Além disso, uma anticorrelação mais forte entre DMN e ECN foi associada a um melhor desempenho em uma tarefa de memória de trabalho verbal no grupo saudável, mas não no grupo de pacientes no início do estudo, e essa associação surgiu no grupo de pacientes após a administração de THC. Os autores interpretaram suas descobertas para indicar um possível efeito da dose, com uma dose menor de THC proporcionando benefícios, melhorando a função do circuito,
Pontos fortes e fracos do estudo do THC
Apenas dois estudos controlados relatados em três artigos estão disponíveis. Ambos os estudos têm muitos pontos fortes, incluindo o uso de controles placebo, medição cuidadosa da exposição anterior ao THC e um grupo de comparação de controle saudável, conforme mostrado na Tabela 1 . Adicionalmente, o estudo de D'Souza et al. estudo ( 55 ) utilizou duas doses de THC, fornecendo um teste de efeito da dose. Apenas o Whitfield-Gabrieli et al. ( 57) relataram níveis séricos de THC, confirmando aumentos moderados que correspondiam à estratégia de dosagem do estudo. Ambos os estudos tiveram amostras pequenas que provavelmente limitaram seu poder de detectar pequenos efeitos. As duas publicações do estudo fMRI não descreveram claramente o processo de randomização, um potencial para viés, nem relataram sintomas ou escores de medidas cognitivas, portanto, a evidência foi indireta, nem o estudo relatou quaisquer efeitos colaterais específicos (Tabelas 1 , 2 ) .
Efeitos do CBD na Esquizofrenia
Em uma série inicial de casos cruzados placebo-CBD-olanzapina, Zuardi et al. ( 35) avaliou os efeitos do CBD nos sintomas e efeitos colaterais em três pacientes do sexo masculino internados com esquizofrenia refratária ao tratamento. Os pacientes receberam primeiro placebo por 5 dias, depois CBD nos dias 6 a 35, titulados de 40 a 1.280 mg/dia. No dia 36, o CBD foi substituído por placebo pelos próximos 5 dias e depois por olanzapina por 15 dias. Os sintomas foram sistematicamente avaliados durante cada período de tratamento. Em um paciente, o CBD foi associado a uma tendência de melhora dos sintomas (sintomas gerais, positivos e negativos da BPRS) na dose de 1.280 mg/dia, e os sintomas pioraram após a descontinuação. Um segundo paciente não apresentou benefício com o CBD, embora os sintomas negativos tenham piorado após a descontinuação. O terceiro paciente apresentou “melhora mínima” dos sintomas. A cognição não foi avaliada.
Hallak et ai. ( 58 ) examinaram os efeitos de CBD 300 ou 600 mg versus placebo na atenção seletiva e na resposta eletrodérmica em 28 pacientes ambulatoriais com esquizofrenia usando uma sessão repetida, desenho não randomizado. Os participantes foram avaliados com o Stroop Color Word Test para avaliar a atenção seletiva, bem como a avaliação psicofisiológica da condutância da pele, dada a pesquisa anterior indicando que a atenção seletiva mais pobre está associada à baixa capacidade de resposta eletrodérmica em pacientes com esquizofrenia ( 71). Os indivíduos foram avaliados em duas sessões com 1 mês de intervalo, com o medicamento do estudo na segunda sessão, na qual os participantes foram classificados em três grupos pareados por idade, sexo, anos de escolaridade e perfil de sintomas. Cada grupo recebeu uma dose única de placebo ou 300 ou 600 mg de CBD e, após 1 h, completou as avaliações de Stroop e condutância da pele. Em contraste com os efeitos hipotéticos, o grupo de 600 mg de CBD cometeu mais erros na condição de interferência do Stroop Color Word Test do que os outros dois grupos, refletindo pior atenção seletiva. Além disso, enquanto os grupos placebo e 300 mg de CBD melhoraram o desempenho na segunda em relação à primeira sessão, o grupo de 600 mg de CBD não. Não foram relatados sintomas psiquiátricos. Este estudo foi limitado pelo tamanho muito pequeno e o teste pode ter sido realizado antes da absorção total do CBD.
Leweke et ai. ( 59 , 60) realizaram um ECR de não inferioridade de grupos paralelos, duplo-cego, de 4 semanas de CBD vs. amisulprida 800 mg em quatro doses divididas entre 42 pacientes psicóticos agudos internados com esquizofrenia e sem transtorno por uso de substâncias. Após pelo menos 3 dias sem antipsicóticos, os pacientes receberam CBD ou amisulprida, titulados em 1 semana e mantidos em 800 mg por mais 3 semanas. Os sintomas (positivos, negativos e totais), relatados no relatório de 2012, melhoraram em ambos os grupos, incluindo uma redução de 30 pontos nos escores totais de sintomas da PANSS e cerca de nove pontos de redução nos sintomas positivos no endpoint de 4 semanas. Não houve diferença de grupo na melhora dos sintomas, sugerindo que o CBD teve um efeito antipsicótico semelhante à amissulprida, embora o teste de não inferioridade não tenha alcançado significância ( 59). Os resultados de uma bateria de testes cognitivos administrados antes e depois do tratamento, relatados no relatório de 2021, demonstraram que ambos os grupos apresentaram melhora da memória visual e velocidade de processamento. O grupo CBD melhorou apenas na atenção sustentada e na coordenação visuomotora, enquanto o grupo amissulprida melhorou na memória de trabalho. Esses achados cognitivos, no entanto, não foram estatisticamente significativos após correção para comparações múltiplas ( 60 ). O CBD foi bem tolerado e associado a menos sintomas extrapiramidais, menor ganho de peso e menor aumento de prolactina do que amisulprida ( 60). Além disso, os níveis séricos de anandamida aumentaram mais entre os tratados com CBD do que com amissulprida, e a extensão do aumento foi associada à melhora na pontuação total da PANSS no grupo CBD, mas não no grupo amissulprida. Este achado foi interpretado como sugerindo uma ligação entre o efeito antipsicótico do CBD e a inibição da degradação da anandamida ( 72 ). Os níveis de anandamida e os escores PANSS não foram correlacionados com o desempenho cognitivo. Os autores interpretaram esse achado como uma sugestão de um mecanismo diferente para o efeito do CBD na cognição. Os grupos de tratamento eram pequenos e o estudo foi insuficiente devido aos desafios de inscrição.
Dois ensaios controlados por placebo de 6 semanas avaliaram a eficácia do aumento de antipsicóticos com CBD. Na primeira, Boggs e colegas ( 61) conduziram um RCT de grupos paralelos, duplo-cego, de 6 semanas de CBD 300 mg BID vs. placebo entre 36 pacientes ambulatoriais com esquizofrenia crônica e nenhum transtorno por uso de substância nos últimos 3 meses em uma dose estável de medicação antipsicótica. A média de idade foi de 48 anos. Os sintomas psicóticos diminuíram com o tempo, mas a melhora não foi diferente entre as condições de tratamento (os escores de sintomas positivos da PANSS melhoraram 2–3 pontos). Em contraste com a direção do efeito hipotético, o grupo placebo mostrou pequenas melhorias na pontuação composta do MCCB, bem como nas pontuações dos domínios Raciocínio e Resolução de Problemas. A sedação foi maior (20% vs. 5%) e os sintomas gastrointestinais foram menos frequentes (33,3% vs. 55,5%) no grupo CBD.
No segundo estudo de aumento de 6 semanas, McGuire e colegas ( 62) conduziram um ECR de grupos paralelos, duplo-cego, de 6 semanas com uma dose mais alta de CBD (500 mg BID) versus placebo entre um grupo maior, 88 pacientes com transtornos do espectro da esquizofrenia, idade média de 41 anos, estáveis com pelo menos pelo menos uma resposta parcial ao tratamento antipsicótico. Além de usar uma dose mais alta de CBD, este estudo diferiu do estudo anterior porque o transtorno por uso de substâncias não era excludente e o uso de álcool, maconha ou outras substâncias ilícitas não era proibido durante o estudo, mas o transtorno por uso de substâncias do DSM-5 diagnóstico não foi informado. No início do estudo, apenas 2,3% do grupo CBD e 4,4% do grupo placebo tiveram uma triagem de urina positiva para THC, sugerindo que a maioria dos participantes não era usuária regular de cannabis antes do estudo. Os níveis séricos de CBD foram positivos em todos os participantes do grupo CBD no final do estudo, sugerindo adesão adequada. Após a fase de tratamento de 6 semanas, em comparação com o placebo, o grupo CBD apresentou maior melhora nos sintomas positivos (redução de 3,2 vs. 1,7 pontos) e teve maior probabilidade de ser classificado como melhorado pelo médico assistente. A alteração total do escore PANSS não foi significativamente diferente entre os grupos (7,9 vs. 8,9 pontos). Tendências também foram observadas para cognição (pontuação composta e domínio da função executiva), bem como melhora pequena, mas significativa, da velocidade motora. Embora as informações sobre o uso de substâncias durante o estudo geralmente não tenham sido fornecidas, os autores relataram que um paciente no grupo CBD era dependente de cannabis no início do estudo e não mudou seu padrão de uso durante o estudo. e outro no grupo CBD era dependente de álcool no início do tratamento, mas não no final do tratamento. O CBD foi bem tolerado, mas, em contraste com o estudo de Boggs acima, os participantes do CBD não relataram sonolência (0% vs. 6,7%) e eram mais propensos a ter efeitos colaterais gastrointestinais do que o grupo placebo (18,6% vs. 6,7 %). Como os participantes que usam THC não foram excluídos e as medidas de uso de THC não foram avaliadas sistematicamente ao longo do tempo, não foi possível descartar uma interação entre o uso de cannabis ou outras substâncias durante o estudo e o efeito do CBD nos sintomas. 7%). Como os participantes que usam THC não foram excluídos e as medidas de uso de THC não foram avaliadas sistematicamente ao longo do tempo, não foi possível descartar uma interação entre o uso de cannabis ou outras substâncias durante o estudo e o efeito do CBD nos sintomas. 7%). Como os participantes que usam THC não foram excluídos e as medidas de uso de THC não foram avaliadas sistematicamente ao longo do tempo, não foi possível descartar uma interação entre o uso de cannabis ou outras substâncias durante o estudo e o efeito do CBD nos sintomas.
O'Neill et ai. ( 63 , 64 ) avaliaram o efeito de uma dose única de aumento com CBD 600 mg versus placebo nos sintomas, avaliações fMRI da ativação do córtex mediotemporal e pré-frontal (principalmente os giros frontal médio e frontal inferior), bem como função mediotemporal-estriatal conectividade durante a recordação verbal, e 1Avaliação H-MRS do nível de glutamato do hipocampo (que foi corrigido para o conteúdo do líquido cefalorraquidiano da região hipocampal de interesse). Eles estudaram 13 pacientes ambulatoriais com esquizofrenia (dentro de 5 anos do início da doença; idade média de 28 anos), em um projeto cruzado duplo-cego, de medidas repetidas e dentro do sujeito. Os pacientes com CUD foram permitidos, enquanto a dependência de álcool e outras substâncias foram excluídas, assim como aqueles que estavam intoxicados ou tiveram uma triagem positiva de drogas na urina para outras drogas no dia do exame. Mais da metade (57,1%) dos pacientes usava maconha. Dezenove participantes saudáveis de comparação (HC) também completaram duas sessões, mas sem administração de medicamentos para o estudo fMRI.
O CBD foi associado a uma tendência de redução da pontuação total mediana do PANSS, mas não a alterações no estado de ansiedade ou no desempenho de tarefas de aprendizagem verbal pareada. Em comparação com o grupo saudável, os pacientes apresentaram ativação anormal na região pré-frontal durante a codificação, enquanto durante a recordação apresentaram ativação pré-frontal e mediotemporal anormal, bem como maior conectividade funcional hipocampo-estriatal. O CBD normalizou parcialmente as ativações nessas regiões, bem como reduziu a hiperconectividade funcional hipocampo-estriatal. Os pesquisadores interpretaram suas descobertas para indicar que as mudanças nessas regiões estão por trás dos efeitos antipsicóticos do CBD.
Além disso, em um relatório de acompanhamento, O'Neill et al. ( 64 ) observaram um aumento significativo nos níveis de glutamato no hipocampo esquerdo no grupo CBD em comparação ao placebo. Nenhuma diferença de grupo foi observada para outros níveis de metabólitos, incluindo glutamato-glutamina, mioinositol, N-acetil aspartato e glicerofosfocolina. Um modelo multivariado ajustado para o escore PANSS basal demonstrou uma relação preditiva inversa significativa entre os níveis de glutamato, mas não a condição de CBD, e os escores PANSS totais. Os autores interpretaram esses achados como suporte à possibilidade de que o CBD possa produzir um efeito antipsicótico por meio da modulação dos níveis de glutamato no hipocampo.
A amostra do estudo foi pequena, mas os autores forneceram um cálculo de poder indicando poder adequado para o estudo fMRI. O design incluiu tempo adequado para a absorção do CBD, permitindo a detecção do efeito do medicamento. No entanto, como metade dos participantes estava usando cannabis recreativa, os autores não puderam determinar se as melhorias associadas ao CBD foram devidas à melhora das deficiências induzidas pelo THC versus deficiências fundamentais para a esquizofrenia.
Pontos fortes e fracos do estudo de CBD
Todos os cinco estudos tiveram pontos fortes consideráveis com atribuição aleatória prospectiva, uma condição de controle ou comparação e avaliação sistemática de sintomas e/ou cognição. Os testes de 4 e 6 semanas também mediram cuidadosamente o impacto nos distúrbios do movimento e efeitos adversos. Nos ensaios de dose única, um estudo pode não ter incluído o tempo adequado para absorção do CBD oral. As diferentes características da amostra (idade, presença de CUD ou uso recente de cannabis), diferentes doses de CBD, duração do tratamento, medidas de resultados e tempo das avaliações podem contribuir para a heterogeneidade dos resultados. Um ponto notável da heterogeneidade do desenho do estudo é a inclusão ou exclusão do uso de CUD e/ou cannabis durante o estudo; ambos os estudos com achados positivos não omitiram participantes com CUD. Os pequenos tamanhos de amostra desses estudos limitaram o poder de detectar efeitos pequenos a médios. O estudo de Boggs não descreveu claramente o processo de randomização e o financiamento da empresa farmacêutica para alguns desses estudos pode contribuir com algum potencial para viés nas descobertas (Tabela 2 ).
Discussão
THC, sintomas psicóticos, cognição e efeitos adversos
Até o momento, pesquisas laboratoriais controladas usaram metodologia heterógona e relataram resultados diferentes. O estudo D'Souza, que foi cuidadosamente elaborado para avaliar os sintomas, documentou aumento dos sintomas positivos, negativos e gerais de psicose, bem como comprometimento da cognição quando o THC intravenoso foi administrado a pacientes com esquizofrenia. Embora tenha havido um claro efeito de dose para aprendizagem e recordação, não houve um claro efeito de dose para sintomas positivos ( 55 ). Esses resultados são consistentes com os achados em indivíduos saudáveis, onde 15 ensaios demonstraram que o THC pode induzir psicose em muitas pessoas ( 28 ).
Em contraste, o outro estudo, que incluiu pacientes com esquizofrenia com CUD concomitante, não relatou mudanças nos sintomas com a administração de uma dose modesta de THC oral e fumado; O THC aumentou significativamente o THC sérico e resultou em uma tendência à taquicardia, conforme esperado. Este estudo demonstrou que o THC reduziu a hiperconectividade funcional do estado de repouso em regiões do DMN e melhorou a anticorrelação DMN-ECN em circuitos cerebrais associados à sintomatologia da esquizofrenia ( 57 ), um efeito oposto ao que se poderia esperar se o THC piorasse a psicose.
A hiperconectividade da DMN foi relatada em pacientes com esquizofrenia ( 74 ) medicados ( 73 ) e não medicados ( 74 ) que não têm CUD. A diminuição da anticorrelação DMN-ECN encontrada também foi documentada em pacientes virgens de medicação ( 74 – 76 ) e pacientes crônicos que tomam medicação ( 73 , 77 , 78). Assim, os autores afirmaram que essas anormalidades podem ser características centrais da esquizofrenia. Eles interpretaram suas descobertas para indicar que o THC pode ter um efeito de dose, com doses baixas proporcionando benefícios aos circuitos cerebrais envolvidos na psicose e doses mais altas causando perturbações. O outro relatório deste estudo mostrou uma normalização da atividade do estado de repouso em circuitos envolvidos com recompensa ( 56 ) e propôs que uma dose baixa de THC também poderia ter o potencial terapêutico para reduzir o uso de cannabis em pacientes com esquizofrenia e CUD concomitantes.
Com relação ao efeito do THC na cognição na esquizofrenia, o THC intravenoso piorou o aprendizado e a recordação em pacientes com esquizofrenia sem transtorno por uso de substâncias, com um efeito de dose em que 5 mg tiveram um efeito maior do que 2,5 mg ( 55 ). Embora o estudo de Whitfield-Gabrielli em pacientes abstinentes com CUD relatasse que o THC melhorou a anticorrelação entre o DMN e o ECN, e a magnitude da anticorrelação entre o DMN e o ECN se correlacionou com o desempenho da memória de trabalho, os escores de cognição em relação ao THC versus placebo não foram relatado. O efeito do THC no estudo D'Souza é consistente com os achados de que o THC piora agudamente a cognição na população em geral ( 55), bem como uma meta-análise indicando melhor funcionamento neuropsicológico em pacientes com esquizofrenia com história de uso de cannabis ao longo da vida, mas não naqueles com uso atual ou recente, em relação a pacientes sem uso concomitante de cannabis ( 79 ).
Além do efeito de dose diferente sugerido por Whitfield-Gabrielli et al. ( 57 ), outras possíveis explicações para os diferentes achados de sintomas e cognição em relação ao THC e sintomas psicóticos nesses estudos de esquizofrenia crônica incluem a possibilidade de que pacientes com esquizofrenia e CUD concomitante possam ser menos suscetíveis aos efeitos psicotomiméticos do THC do que aqueles que não têm CUD, seja por diferentes riscos biológicos subjacentes, noção que outros propuseram ( 80), ou devido ao desenvolvimento de adaptações neurais que resultam em tolerância a esse efeito após o uso prolongado de cannabis. Em relação ao risco biológico heterogêneo para psicose, a suscetibilidade interindividual a sintomas psicóticos induzidos por THC foi observada em pessoas sem transtornos psicóticos ( 27 , 81 ). Supondo que essa heterogeneidade também exista em pessoas com esquizofrenia, é possível que aqueles com menor suscetibilidade à exacerbação dos sintomas tenham maior probabilidade de desenvolver um CUD, pois não sofreriam consequências negativas imediatas com o uso de THC. O curso problemático da doença associada ao CUD na esquizofrenia pode ser devido ao impacto prejudicial mais geral dos transtornos por uso de substâncias na esquizofrenia, incluindo a não adesão à medicação ( 82 –84 ). Alternativamente, pessoas com esquizofrenia e CUD podem ter desenvolvido tolerância aos efeitos psicotógenos do THC, como foi demonstrado em pessoas sem transtornos psicóticos ( 81 , 85 ).
CBD, sintomas psicóticos, cognição e efeitos colaterais
A pesquisa prospectiva controlada sobre o impacto do CBD até o momento é mista. O pequeno estudo comparando 800 mg de CBD com amissulprida entre 42 pacientes internados sintomáticos e não medicados (média de idade de 30 anos) com teste negativo para THC e transtorno por uso de substâncias demonstrou uma redução de 30 pontos nos escores totais da PANSS em 4 semanas e cerca de 9 pontos de redução nos positivos sintomas de psicose em ambos os grupos ( 59 ). Embora este estudo não tenha um grupo de controle placebo, os resultados sugerem fortemente que o CBD tem um efeito antipsicótico. Um artigo recente também relatou avaliações de cognição deste mesmo estudo, indicando níveis semelhantes de melhora com CBD e amissulprida, mas sem significância estatística após correção para comparações múltiplas ( 60). Os quatro pequenos estudos controlados por placebo de aumento do CBD na esquizofrenia fornecem suporte misto e limitado para a capacidade do CBD adicionado a um antipsicótico de reduzir ainda mais os sintomas de psicose e melhorar os prejuízos cognitivos. Em contraste com a pesquisa sobre o THC, esta pesquisa demonstrou que o CBD não piorou a psicose ou a cognição em comparação com o placebo.
Esses resultados inconsistentes em relação aos potenciais efeitos benéficos do CBD podem ser devidos a diferentes doses de CBD, diferentes idades do paciente e presença de THC recreativo recente/atual e outras exposições a substâncias nesses estudos. Entre os dois ensaios de aumento de 6 semanas, o estudo que demonstrou um efeito positivo nos sintomas e na cognição ( 62 ) usou uma dose mais alta de CBD (1.000 mg vs. 600 mg) e inscreveu indivíduos com uma média de idade menor (41 vs. 48 anos). Assim, é possível que uma dose maior seja necessária ou que pacientes mais jovens respondam melhor ao CBD. As descobertas do efeito do CBD usando fMRI nos estudos revisados aqui ( 63), que também recrutou indivíduos jovens, são semelhantes aos estudos recentes de fMRI em adultos jovens, virgens de antipsicóticos com alto risco clínico de psicose. Esses ensaios encontraram normalização parcial dos circuitos envolvidos no aprendizado verbal e na memória ( 86 ) e relevância motivacional ( 87 ) após uma única dose de CBD. As novas descobertas de 1 H-MRS sugerem um possível mecanismo para o impacto do CBD nos sintomas da esquizofrenia ( 64 ). Juntos, esses achados sugerem que os efeitos do CBD no funcionamento do cérebro na esquizofrenia não podem ser facilmente explicados por fatores relacionados à doença, como histórico de medicamentos e cronicidade.
Um ponto de interesse significativo é que os estudos que encontraram um efeito positivo para o aumento do CBD ( 62 – 64 ) não omitiram participantes com CUD ou uso atual de cannabis e não mediram cuidadosamente o uso de cannabis durante o período do estudo. Pesquisas anteriores demonstraram que o CBD em doses robustas pode atenuar os sintomas psicóticos induzidos por THC em indivíduos saudáveis ( 29 , 30). Assim, é possível que o CBD estivesse influenciando as deficiências induzidas pelo THC em vez das deficiências devido à esquizofrenia nesses dois estudos com resultados positivos. Também é possível que pessoas com esquizofrenia que usam cannabis ou têm um CUD possam responder de maneira diferente ao CBD daqueles que não têm CUD, mas nenhum estudo examinou cuidadosamente o efeito do CBD em pacientes com esquizofrenia e CUD. Além disso, não encontramos estudos de laboratório publicados testando a combinação de CBD com THC na esquizofrenia, nem entre aqueles com CUD co-ocorrente. Pacientes com distúrbios concomitantes são de particular interesse, dados os achados preliminares de que doses baixas de THC normalizaram a conectividade funcional do estado de repouso em áreas relacionadas ao processamento de recompensa e controle executivo sem aumentar os sintomas ou piorar a cognição ( 56, 57).
Esta revisão é limitada pelo pequeno número de estudos controlados disponíveis sobre o assunto, mas a consideração de estudos de CBD e THC, juntamente com uma revisão cuidadosa da metodologia e dos resultados do estudo, fornece uma importante avaliação atual das evidências sobre o efeito da cannabis na esquizofrenia . É importante ressaltar que revisões anteriores não levaram em consideração se os pacientes estavam usando álcool ou substâncias de abuso (incluindo maconha) no momento da participação e/ou tinham história prévia de transtorno por uso de álcool ou substâncias. O histórico de uso de álcool/substâncias pode ser especialmente importante a ser considerado, pois pode afetar os resultados dos testes de THC ou CBD na esquizofrenia. Essa possibilidade é levantada por pesquisas que indicam efeitos diferenciais da administração aguda de canabinóides na cognição ( 88 ,89 ) e classificações de intoxicação ( 90 , 91 ) em usuários frequentes e infrequentes de cannabis sem esquizofrenia, bem como maior nível inicial máximo de THC no plasma em usuários frequentes ( 90 , 92 ).
No geral, não há evidências suficientes sobre a capacidade do THC ou do CBD de afetar os sintomas e a cognição em pacientes com esquizofrenia, de modo que nenhum dos canabinóides deve ser recomendado para tratar esse grupo até que pesquisas adicionais permitam uma imagem mais clara de seu impacto nessa doença e entre as pessoas. que têm esquizofrenia e CUD. Na era da legalização, as autoridades de saúde pública poderiam considerar se há evidências suficientes relacionadas ao THC (de um estudo de laboratório de alta qualidade consistente com pesquisas epidemiológicas e efeitos em pessoas sem transtornos psicóticos) para fornecer avisos públicos de que o THC pode piorar os sintomas entre algumas pessoas com esquizofrenia. Estudar o efeito do THC e do CBD na esquizofrenia é um desafio,
Declaração de Disponibilidade de Dados
As contribuições originais apresentadas no estudo estão incluídas no artigo/material suplementar, mais perguntas podem ser dirigidas ao(s) autor(es) correspondente(s).
Contribuições do autor
CS e MB determinaram o desenho do estudo e contribuíram para o desenvolvimento do protocolo original. SA e CS contribuíram para a triagem original dos artigos, extração de dados e redação do primeiro rascunho do manuscrito. RR contribuiu com o desenho do estudo. MB e RR conduziram a análise, interpretação da revisão da literatura e revisão crítica do manuscrito. MB, RR e SA contribuíram para a edição da versão final. Todos os autores aprovaram a versão final.
Financiamento
Este trabalho foi financiado em parte por uma bolsa do National Institute on Drug Abuse para MB (1R01DA034699-01).
Conflito de interesses
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
Nota do editor
Todas as reivindicações expressas neste artigo são exclusivamente dos autores e não representam necessariamente as de suas organizações afiliadas, ou as do editor, dos editores e dos revisores. Qualquer produto que possa ser avaliado neste artigo, ou reclamação que possa ser feita por seu fabricante, não é garantido ou endossado pelo editor.
Agradecimentos
Os autores gostariam de agradecer a contribuição de Karen Goodman, MSLIS, MA, bibliotecária médica da Dorothy M. Breene Memorial Library no New Hampshire Hospital, pela assistência na pesquisa bibliográfica e obtenção dos artigos necessários para este artigo.
Referências
1. Preto DW, Andreasen NC. Tratado introdutório de psiquiatria . Arlington, VA: American Psychiatric Pub (2011).
2. Mueser KT, McGurk SR. Esquizofrenia. Lanceta. (2004) 363:2063–72. doi: 10.1016/S0140-6736(04)16458-1
3. Gold JM, Waltz JA, Prentice KJ, Morris SE, Heerey EA. Processamento de recompensa na esquizofrenia: um déficit na representação de valor. Touro Esquizofrênico. (2008) 34:835–47. doi: 10.1093/schbul/sbn068
4. Achim AM, Maziade M, Raymond É, Olivier D, Mérette C, Roy -A, et al. Qual a prevalência dos transtornos de ansiedade na esquizofrenia? Uma meta-análise e revisão crítica sobre uma associação significativa. Touro Esquizofrênico. (2011) 37:811–21. doi: 10.1093/schbul/sbp148
5. Kiran C, Chaudhury S. Prevalência de transtornos de ansiedade comórbidos na esquizofrenia. Ind Psiquiatria J . (2016) 25:35. doi: 10.4103/0972-6748.196045
6. Green B, Young R, Kavanagh D. Prevalência do uso e abuso de maconha entre pessoas com psicose. Br J Psiquiatria. (2005) 187:306–13. doi: 10.1192/bjp.187.4.306
7. Mueser KT, Yarnold PR, Rosenberg SD, Swett Jr C, Miles KM, Hill D. Transtorno de uso de substâncias em pacientes psiquiátricos gravemente doentes mentais hospitalizados: prevalência, correlatos e subgrupos. Touro Esquizofrênico. (2000) 26:179–92. doi: 10.1093/oxfordjournals.schbul.a033438
8. Ringen P, Lagerberg T, Birkenaes A, Engn J, Faerden A, Jonsdottir H, et al. Diferenças na prevalência e padrões de uso de substâncias na esquizofrenia e no transtorno bipolar. Psicol Med. (2008) 38:1241. doi: 10.1017/S003329170700236X
9. Sevy S, Robinson DG, Holloway S, Alvir JM, Woerner MG, Bilder R, et al. Correlatos do uso indevido de substâncias em pacientes com primeiro episódio de esquizofrenia e transtorno esquizoafetivo. Acta Psychiatr Scand. (2001) 104:367–74. doi: 10.1111/j.1600-0447.2001.00452.x
10. Green AI, Noordsy DL, Brunette MF, O'Keefe C. Abuso de substâncias e esquizofrenia: intervenção farmacoterapêutica. J Subst Abuse Tratar. (2008) 34:61–71. doi: 10.1016/j.jsat.2007.01.008
11. Henquet C, Murray R, Linszen D, van Os. J. O meio ambiente e a esquizofrenia: o papel do uso de cannabis. Touro Esquizofrênico. (2005) 31:608–12. doi: 10.1093/schbul/sbi027
12. Koskinen J, Löhönen J, Koponen H, Isohanni M, Miettunen J. Taxa de transtornos por uso de cannabis em amostras clínicas de pacientes com esquizofrenia: uma meta-análise. Touro Esquizofrênico. (2010) 36:1115–30. doi: 10.1093/schbul/sbp031
13. Regier DA, Farmer ME, Rae DS, Locke BZ, Keith SJ, Judd LL, et al. Comorbidade de transtornos mentais com abuso de álcool e outras drogas: resultados do estudo Epidemiologic Catchment Area (ECA). JAMA. (1990) 264:2511-8. doi: 10.1001/jama.1990.03450190043026
14. Hasin DS, Kerridge BT, Saha TD, Huang B, Pickering R, Smith SM, et al. Prevalência e correlatos do transtorno do uso de cannabis do DSM-5, 2012-2013: resultados da Pesquisa Epidemiológica Nacional sobre Álcool e Condições Relacionadas – III. Am J Psiquiatria . (2016) 173:588–99. doi: 10.1176/appi.ajp.2015.15070907
15. Arseneault L, Cannon M, Poulton R, Murray R, Caspi A, Moffitt TE. Uso de cannabis na adolescência e risco de psicose em adultos: estudo prospectivo longitudinal. BM J. (2002) 325:1212–13. doi: 10.1136/bmj.325.7374.1212
16. Griffith-Lendering M, Wigman J, Prince van Leeuwen A, Huijbregts S, Huizink AC, Ormel J, et al. Uso de Cannabis e vulnerabilidade para psicose no início da adolescência – um estudo TRAILS. Vício. (2013) 108:733–40. doi: 10.1111/add.12050
17. Marconi A, Di Forti M, Lewis CM, Murray RM, Vassos E. Meta-análise da associação entre o nível de uso de cannabis e o risco de psicose. Touro Esquizofrênico. (2016) 42:1262–9. doi: 10.1093/schbul/sbw003
18. Miettunen J, Törmänen S, Murray GK, Jones PB, Mäki P, Ebeling H, et al. Associação do uso de cannabis com sintomas prodrômicos de psicose na adolescência. Br J Psiquiatria. (2008) 192:470–1. doi: 10.1192/bjp.bp.107.045740
19. Stefanis N, Delespaul P, Henquet C, Bakoula C, Stefanis C, Van Os J. Exposição precoce à cannabis na adolescência e dimensões positivas e negativas da psicose. Vício. (2004) 99:1333–41. doi: 10.1111/j.1360-0443.2004.00806.x
20. Ben-Zeev D, Ellington K, Swendsen J, Granholm E. Examinando um modelo cognitivo de ideação persecutória na vida diária de pessoas com esquizofrenia: um estudo computadorizado de amostragem de experiência. Touro Esquizofrênico. (2011) 37:1248–56. doi: 10.1093/schbul/sbq041
21. Buckley PF, Miller BJ, Lehrer DS, Castle DJ. Comorbidades psiquiátricas e esquizofrenia. Touro Esquizofrênico. (2009) 35:383–402. doi: 10.1093/schbul/sbn135
22. Henquet C, van Os J, Kuepper R, Delespaul P, Smits M, Campo JA, et al. Reatividade de psicose ao uso de cannabis na vida diária: um estudo de amostragem de experiência. Br J Psiquiatria. (2010) 196:447–53. doi: 10.1192/bjp.bp.109.072249
23. Zammit S, Moore TH, Lingford-Hughes A, Barnes TR, Jones PB, Burke M, et al. Efeitos do uso de cannabis nos resultados de transtornos psicóticos: revisão sistemática. Br J Psiquiatria. (2008) 193:357–63. doi: 10.1192/bjp.bp.107.046375
24. Hasin DS. Epidemiologia do uso de cannabis nos EUA e problemas associados. Neuropsicofarmacologia. (2018) 43:195–212. doi: 10.1038/npp.2017.198
25. Babalonis S, Haney M, Malcolm RJ, Lofwall MR, Votaw VR, Sparenborg S, et al. O canabidiol oral não produz um sinal de risco de abuso em fumantes frequentes de maconha. Droga Álcool Depende. (2017) 172:9–13. doi: 10.1016/j.drogalcdep.2016.11.030
26. Haney M, Malcolm RJ, Babalonis S, Nuzzo PA, Cooper ZD, Bedi G, et al. O canabidiol oral não altera os efeitos subjetivos, reforçadores ou cardiovasculares da cannabis fumada. Neuropsicofarmacologia. (2016) 41:1974–82. doi: 10.1038/npp.2015.367
27. D'Souza DC, Perry E, MacDougall L, Ammerman Y, Cooper T, Braley G, et al. Os efeitos psicotomiméticos do delta-9-tetraidrocanabinol intravenoso em indivíduos saudáveis: implicações para a psicose. Neuropsicofarmacologia. (2004) 29:1558–72. doi: 10.1038/sj.npp.1300496
28. Sherif M, Radhakrishnan R, D'Souza DC, Ranganathan M. Estudos de laboratório humano sobre canabinóides e psicose. Psiquiatria Biol. (2016) 79:526–38. doi: 10.1016/j.biopsych.2016.01.011
29. Bhattacharyya S, Morrison PD, Fusar-Poli P, Martin-Santos R, Borgwardt S, Winton-Brown T, et al. Efeitos opostos de Δ-9-tetrahidrocanabinol e canabidiol na função cerebral humana e psicopatologia. Neuropsicofarmacologia. (2010) 35:764–74. doi: 10.1038/npp.2009.184
30. Englund A, Morrison PD, Nottage J, Hague D, Kane F, Bonaccorso S, et al. O canabidiol inibe os sintomas paranóides induzidos pelo THC e o comprometimento da memória dependente do hipocampo. J Psychopharmacol. (2013) 27:19–27. doi: 10.1177/0269881112460109
31. Leweke FM, Schneider U, Radwan M, Schmidt E, Emrich HM. Diferentes efeitos de nabilona e canabidiol na inversão de profundidade binocular no homem. Pharmacol Biochem Behav. (2000) 66:175–81. doi: 10.1016/S0091-3057(00)00201-X
32. Schubart CD, Sommer IE, van Gastel WA, Goetgebuer RL, Kahn RS, Boks MP. A cannabis com alto teor de canabidiol está associada a menos experiências psicóticas. Esquizofre Res. (2011) 130:216–21. doi: 10.1016/j.schres.2011.04.017
33. ElSohly MA, Mehmedic Z, Foster S, Gon C, Chandra S, Church JC. Mudanças na potência da cannabis nas últimas 2 décadas (1995–2014): análise dos dados atuais nos Estados Unidos. Psiquiatria Biol. (2016) 79:613–9. doi: 10.1016/j.biopsych.2016.01.004
34. Bidwell LC, Mueller R, YorkWilliams SL, Hagerty S, Bryan AD, Hutchison KE. Um novo método observacional para avaliar respostas agudas à cannabis: validação preliminar usando cepas legais do mercado. Cannabis Cannabinoid Res. (2018) 3:35–44. doi: 10.1089/can.2017.0038
35. Zuardi AW, Crippa J, Hallak J, Moreira F, Guimarães F. Cannabidiol, um constituinte da Cannabis sativa, como droga antipsicótica. Brasileiro J Med Biol Res. (2006) 39:421–9. doi: 10.1590/S0100-879X2006000400001
36. Zuardi AW, Morais S, Guimarães F, Mechoulam R. Efeito antipsicótico do canabidiol. Psiquiatria J Clin. (1995) 56:485-6.
37. Soluções DG. Mapa da Legalidade da Maconha por Estado . Houston, TX: DISA Global Solutions (2021).
38. Keyhani S, Steigerwald S, Ishida J, Vali M, Cerdá M, Hasin D, et al. Riscos e benefícios do uso de maconha: uma pesquisa nacional com adultos americanos. Ann Intern Med. (2018) 169:282–9 doi: 10.7326/M18-0810
39. Reinarman C, Nunberg H, Lanthier F, Heddleston T. Quem são os pacientes de maconha medicinal? Características da população de nove clínicas de avaliação da Califórnia. J Psychoact Drugs. (2011) 43:128–35. doi: 10.1080/02791072.2011.587700
40. Adlaf EM, Begin P, Sawka E. Pesquisa de Dependência Canadense (CAS): Uma Pesquisa Nacional sobre o Uso de Álcool e Outras Drogas pelos Canadenses: Prevalência de Uso e Danos Relacionados: Relatório Detalhado . Ottawa, ON: Centro Canadense sobre Abuso de Substâncias (2005).
41. Walsh Z, Callaway R, Belle-Isle L, Capler R, Kay R, Lucas P, et al. Cannabis para fins terapêuticos: características do paciente, acesso e motivos de uso. Política de Drogas Int J. (2013) 24:511–6. doi: 10.1016/j.drugpo.2013.08.010
42. Wigman JT, van Nierop M, Vollebergh WA, Lieb R, Beesdo-Baum K, Wittchen U, et al. Evidências de que os sintomas psicóticos são prevalentes em transtornos de ansiedade e depressão, impactando no início, risco e gravidade da doença - implicações para diagnóstico e pesquisa de risco ultra-alto. Touro Esquizofrênico. (2012) 38:247–57. doi: 10.1093/schbul/sbr196
43. Bartoli F, Riboldi I, Bachi B, Calabrese A, Moretti F, Crocamo C, et al. Eficácia do canabidiol para sintomas psicóticos induzidos por δ-9-tetrahidrocanabinol, esquizofrenia e transtornos por uso de cannabis: uma revisão narrativa. J Clin Med. (2021) 10:1303. doi: 10.3390/jcm10061303
44. Batalla A, Janssen H, Gangadin SS, Bossong MG. O potencial do canabidiol como tratamento para psicose e dependência: quem se beneficia mais? Uma revisão sistemática. J Clin Med. (2019) 8:1058. doi: 10.3390/jcm8071058
45. Bonaccorso S, Ricciardi A, Zangani C, Chiappini S, Schifano F. Uso de canabidiol (CBD) em transtornos psiquiátricos: uma revisão sistemática. Neurotoxicologia. (2019) 74:282–98. doi: 10.1016/j.neuro.2019.08.002
46. Davies C, Bhattacharyya S. Canabidiol como um tratamento potencial para psicose. Ther Adv Psychopharmacol. (2019) 9:2045125319881916. doi: 10.1177/2045125319881916
47. Ghabrash MF, Coronado-Montoya S, Aoun J, Gagn é A.-A., Mansour F, et al. Canabidiol para o tratamento da psicose entre pacientes com esquizofrenia e outros transtornos psicóticos primários: uma revisão sistemática com risco de viés de avaliação. Res. de Psiquiatria. (2020) 286:112890. doi: 10.1016/j.psychres.2020.112890
48. Osborne AL, Solowij N, Weston-Green K. Uma revisão sistemática do efeito do canabidiol na função cognitiva: relevância para a esquizofrenia. Neurosci Biobehav Rev. (2017) 72:310–24. doi: 10.1016/j.neubiorev.2016.11.012
49. Saeed SA, Clary KE. Canabidiol para psicose: uma revisão de 4 estudos. Curr Psychiatr. (2020) 19:24–31. doi: 10.12788/cp.0002
50. Schoevers J, Leweke JE, Leweke FM. Canabidiol como opção de tratamento para esquizofrenia: evidências recentes e estudos atuais. Curr Opin Psychiatry. (2020) 33:185–91. doi: 10.1097/YCO.0000000000000596
51. Meader N, King K, Llewellyn A, Norman G, Brown J, Rodgers M, et al. Uma lista de verificação projetada para ajudar na consistência e reprodutibilidade das avaliações GRADE: desenvolvimento e validação piloto. Syst Rev. (2014) 3:1–9. doi: 10.1186/2046-4053-3-82
52. Guyatt GH, Oxman AD, Vist G, Kunz R, Brozek J, Alonso-Coello P, et al. Diretrizes GRADE: 4. Avaliação da qualidade da evidência — limitações do estudo (risco de viés). J Clin Epidemiol. (2011) 64:407–15. doi: 10.1016/j.jclinepi.2010.07.017
53. Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, et al. GRADE: um consenso emergente sobre a classificação da qualidade da evidência e a força das recomendações. Bmj. (2008) 336:924–6. doi: 10.1136/bmj.39489.470347.AD
54. Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. A ferramenta da Colaboração Cochrane para avaliar o risco de viés em ensaios randomizados. BMJ . (2011) 343:d5928. doi: 10.1136/bmj.d5928
55. D'Souza DC, Abi-Saab WM, Madonick S, Forselius-Bielen K, Doersch A, Braley G, et al. Efeitos do delta-9-tetraidrocanabinol na esquizofrenia: implicações para cognição, psicose e vício. Psiquiatria Biol. (2005) 57:594–608. doi: 10.1016/j.biopsych.2004.12.006
56. Fischer AS, Whitfield-Gabrieli S, Roth RM, Brunette MF, Green AI. Conectividade funcional prejudicada do circuito de recompensa cerebral em pacientes com esquizofrenia e transtorno por uso de cannabis: efeitos da cannabis e do THC. Esquizofre Res. (2014) 158:176–82. doi: 10.1016/j.schres.2014.04.033
57. Whitfield-Gabrieli S, Fischer AS, Henricks AM, Khokhar JY, Roth RM, Brunette MF, et al. Compreendendo os efeitos da maconha na conectividade funcional da rede de modo padrão em pacientes com esquizofrenia e transtorno de uso concomitante de cannabis: uma investigação piloto. Esquizofre Res. (2018) 194:70–7. doi: 10.1016/j.schres.2017.07.029
58. Hallak JE, Machado-de-Sousa JP, Crippa JAS, Sanches RF, Trzesniak C, Chaves C, et al. Desempenho de pacientes esquizofrênicos no Stroop Color Word Test e responsividade eletrodérmica após administração aguda de canabidiol (CBD). Psiquiatria Braz J. (2010) 32:56–61. doi: 10.1590/S1516-44462010000100011
59. Leweke F, Piomelli D, Pahlisch F, Muhl D, Gerth C, Hoyer C, et al. O canabidiol aumenta a sinalização da anandamida e alivia os sintomas psicóticos da esquizofrenia. Transl Psiquiatria. (2012) 2:e94. doi: 10.1038/tp.2012.15
60. Leweke FM, Rohleder C, Gerth CW, Hellmich M, Pukrop R, Koethe D. O canabidiol e amisulprida melhoram a cognição na esquizofrenia aguda em um estudo clínico randomizado exploratório, duplo-cego, controlado por ativo. Front Farmacol . (2021) 12:614811. doi: 10.3389/fphar.2021.614811
61. Boggs DL, Nguyen JD, Morgenson D, Taffe MA, Ranganathan M. Evidência clínica e pré-clínica para interações funcionais de canabidiol e Δ 9-tetraidrocanabinol. Neuropsicofarmacologia. (2018) 43:142–54. doi: 10.1038/npp.2017.209
62. McGuire P, Robson P, Cubala WJ, Vasile D, Morrison PD, Barron R, et al. Canabidiol (CBD) como terapia adjuvante na esquizofrenia: um estudo controlado randomizado multicêntrico. Am J Psiquiatria. (2018) 175:225–31. doi: 10.1176/appi.ajp.2017.17030325
63. O'Neill A, Wilson R, Blest-Hopley G, Annibale L, Colizzi M, Brammer M, et al. A normalização da atividade mediotemporal e pré-frontal, conectividade mediotemporal-estriatal pode estar subjacente aos efeitos antipsicóticos do canabidiol na psicose. Psychol Med . (2020) 51:596–606. doi: 10.1017/S0033291719003519
64. O'Neill A, Annibale L, Blest-Hopley G, Wilson R, Giampietro V, Bhattacharyya S. Cannabidiol modulação do glutamato hipocampal na psicose precoce. J Psychopharmacol . 32:56–61. (2021). doi: 10.1177/02698811211001107
65. Geral JE, Gorham DR. A breve escala de avaliação psiquiátrica. Psychol Rep. (1962) 10:799–812. doi: 10.2466/pr0.1962.10.3.799
66. Kay SR, Fiszbein A, Opler LA. A escala de síndrome positiva e negativa (PANSS) para esquizofrenia. Touro Esquizofrênico. (1987) 13:261. doi: 10.1093/schbul/13.2.261
67. Barnes TR. Uma escala de classificação para acatisia induzida por drogas. Br J Psiquiatria. (1989) 154:672–76. doi: 10.1192/bjp.154.5.672
68. Hawley C, Fineberg N, Roberts A, Baldwin D, Sahadevan A, Sharman V. O uso da Escala Simpson Angus para a avaliação do distúrbio do movimento: um guia de treinamento. Int J Psychiatry Clin Pract. (2003) 7:349–2257. doi: 10.1080/13651500310002986
69. Munetz MR, Benjamin S. Como examinar pacientes usando a Escala de Movimento Involuntário Anormal. Serviço Psiquiátrico. (1988) 39:1172–7. doi: 10.1176/ps.39.11.1172
70. Sobell LC, Sobell MB. Acompanhamento da linha do tempo. In: Litten R e Allen J, editores. Medindo o Consumo de Álcool . Totowa, NJ: Humana Press (1992). pág. 41–72.
71. Lopes-Machado EZ, de Souza Crippa JA, Hallak JEC, Guimarães FS, Zuardi AW. Pacientes com esquizofrenia sem resposta eletrodérmica cometem mais erros no Stroop Color Word Test, indicando déficit de atenção seletiva. Touro Esquizofrênico. (2002) 28:459–66. doi: 10.1093/oxfordjournals.schbul.a006953
72. Bisogno T, Hanuš L, De Petrocellis L, Tchilibon S, Ponde DE, Brandi I, et al. Alvos moleculares para o canabidiol e seus análogos sintéticos: efeito nos receptores vanilóides VR1 e na captação celular e hidrólise enzimática da anandamida. Br J Pharmacol. (2001) 134:845–52. doi: 10.1038/sj.bjp.0704327
73. Zhou Y, Liang M, Tian L, Wang K, Hao Y, Liu H, et al. Desintegração funcional na esquizofrenia paranóide usando fMRI em estado de repouso. Esquizofre Res. (2007) 97:194–205. doi: 10.1016/j.schres.2007.05.029
74. Whitfield-Gabrieli S, Thermenos HW, Milanovic S, Tsuang MT, Faraone SV, McCarley RW, et al. Hiperatividade e hiperconectividade da rede padrão na esquizofrenia e em parentes de primeiro grau de pessoas com esquizofrenia. Proc Nat Acad Sci. (2009) 106:1279–84. doi: 10.1073/pnas.0809141106
75. Hamilton LS, Altshuler LL, Townsend J, Bookheimer SY, Phillips OR, Fischer J. Alterações na ativação funcional no transtorno bipolar eutímico e na esquizofrenia durante uma tarefa de memória de trabalho. Hum Brain Mapp. (2009) 30:3958–69. doi: 10.1002/hbm.20820
76. Ortiz-Gil J, Pomarol-Clotet E, Salvador R, Canales-Rodríguez EJ, Sarro S, Gomar JJ, et al. Correlatos neurais do comprometimento cognitivo na esquizofrenia. Br J Psiquiatria. (2011) 199:202–10. doi: 10.1192/bjp.bp.110.083600
77. Repovs G, Csernansky JG, Barch DM. Conectividade da rede cerebral em indivíduos com esquizofrenia e seus irmãos. Psiquiatria Biol. (2011) 69:967–73. doi: 10.1016/j.biopsych.2010.11.009
78. Woodward ND, Rogers B, Heckers S. Redes funcionais em estado de repouso são afetadas diferentemente na esquizofrenia. Esquizofre Res. (2011) 130:86–93. doi: 10.1016/j.schres.2011.03.010
79. Yücel M, Bora E, Lubman DI, Solowij N, Brewer WJ, Cotton SM, et al. O impacto do uso de cannabis no funcionamento cognitivo em pacientes com esquizofrenia: uma meta-análise das descobertas existentes e novos dados em uma amostra do primeiro episódio. Touro Esquizofrênico. (2012) 38:316–30. doi: 10.1093/schbul/sbq079
80. Sami MB, Bhattacharyya S. Os pacientes usuários e não usuários de cannabis são grupos diferentes? Para entender a neurobiologia do uso de cannabis em transtornos psicóticos. J Psychopharmacol. (2018) 32:825–49. doi: 10.1177/0269881118760662
81. Morrison P, Zois V, McKeown D, Lee T, Holt D, Powell J, et al. Os efeitos agudos do intravenoso sintético [Delta] 9-tetrahidrocanabinol na psicose, humor e funcionamento cognitivo. Psicol Med. (2009) 39:1607. doi: 10.1017/S0033291709005522
82. Abdel-Baki A, Ouellet-Plamondon C, Salvat É, Grar K, Potvin S. Resultados sintomáticos e funcionais da persistência do transtorno por uso de substâncias 2 anos após a admissão em um programa de primeiro episódio psicótico. Res. de Psiquiatria. (2017) 247:113–19. doi: 10.1016/j.psychres.2016.11.007
83. Higashi K, Medic G, Littlewood KJ, Diez T, Granström O, De Hert M. Adesão à medicação na esquizofrenia: fatores que influenciam a adesão e consequências da não adesão, uma revisão sistemática da literatura. Ther Adv Psychopharmacol. (2013) 3:200–18. doi: 10.1177/2045125312474019
84. Wilk J, Marcus SC, West J, Countis L, Hall R, Regier DA, et al. Abuso de substâncias e o manejo da não adesão à medicação na esquizofrenia. J Nerv Ment Dis. (2006) 194:454–7. doi: 10.1097/01.nmd.0000221289.54911.63
85. D'souza DC, Ranganathan M, Braley G, Gueorguieva R, Zimolo Z, Cooper T, et al. Efeitos psicotomiméticos e amnésticos atenuados do Δ-9-tetrahidrocanabinol em usuários frequentes de cannabis. Neuropsicofarmacologia. (2008) 33:2505–16. doi: 10.1038/sj.npp.1301643
86. Bhattacharyya S, Wilson R, Appiah-Kusi E, O'Neill A, Brammer M, Perez J, et al. Efeito do canabidiol na disfunção temporal medial, mesencéfalo e estriatal em pessoas com alto risco clínico de psicose: um ensaio clínico randomizado. JAMA Psiquiatria. (2018) 75:1107–17. doi: 10.1001/jamapsychiatry.2018.2309
87. Wilson R, Bossong MG, Appiah-Kusi E, Petros N, Brammer M, Perez J, et al. O canabidiol atenua a disfunção insular durante o processamento de saliência motivacional em indivíduos com alto risco clínico de psicose. Transl Psiquiatria. (2019) 9:1–10. doi: 10.1038/s41398-019-0534-2
88. Ramaekers J, Van Wel J, Spronk D, Toennes S, Kuypers K, Theunissen E, e outros Cannabis e tolerância: prejuízo agudo de drogas em função do histórico de uso de cannabis. Representante Científico (2016) 6:1–9. doi: 10.1038/srep31939
89. Sewell RA, Schnakenberg A, Elander J, Radhakrishnan R, Williams A, Skosnik PD, et al. Efeitos agudos do THC na percepção do tempo em usuários frequentes e infrequentes de cannabis. Psicofarmacologia. (2013) 226:401–13. doi: 10.1007/s00213-012-2915-6
90. Fabritius M, Chtioui H, Battistella G, Annoni J.-M., Dao K, et al. Comparação das concentrações de canabinóides no fluido oral e no sangue total entre fumantes ocasionais e regulares de cannabis antes e depois de fumar um baseado de cannabis. Anal Bioanal Chem. (2013) 405:9791–803. doi: 10.1007/s00216-013-7412-1
91. Solowij N, Broyd S, Greenwood L.-,m., van Hell H, Martelozzo D, et al. Um estudo controlado randomizado de Δ 9-tetraidrocanabinol vaporizado e canabidiol sozinho e em combinação em usuários frequentes e infrequentes de cannabis: efeitos agudos de intoxicação. Eur Arch Psychiatry Clin Neurosci. (2019) 269:17–35. doi: 10.1007/s00406-019-00978-2
Palavras-chave: cannabis, maconha, Esquizofrenia, psicose, CBD, THC, legalização, fMRI
Citação: Ahmed S, Roth RM, Stanciu CN e Brunette MF (2021) O impacto do THC e do CBD na esquizofrenia: uma revisão sistemática. Frente. Psychiatry 12:694394. doi: 10.3389/fpsyt.2021.694394
Recebido: 13 de abril de 2021; Aceito: 25 de junho de 2021;
Publicação: 23 de julho de 2021.
Revisados pela:
Michael Patrick Schaub , Universidade de Zurique, SuíçaLiangsuo Ma , Virginia Commonwealth University, Estados Unidos
Copyright © 2021 Ahmed, Roth, Stanciu e Morena. Este é um artigo de acesso aberto distribuído sob os termos da Creative Commons Attribution License (CC BY) . O uso, distribuição ou reprodução em outros fóruns é permitido, desde que o(s) autor(es) original(is) e o(s) detentor(es) dos direitos autorais sejam creditados e que a publicação original nesta revista seja citada, de acordo com a prática acadêmica aceita. Nenhum uso, distribuição ou reprodução é permitido que não esteja de acordo com estes termos.
*Correspondência: Mary F. Brunette, mary.f.brunette@hitchcock.org
Isenção de responsabilidade: todas as reivindicações expressas neste artigo são exclusivamente dos autores e não representam necessariamente as de suas organizações afiliadas ou as do editor, dos editores e dos revisores. Qualquer produto que possa ser avaliado neste artigo ou reclamação que possa ser feita por seu fabricante não é garantido ou endossado pelo editor.