Abstrato
A terapia com psilocibina mostra potencial antidepressivo, mas suas ações terapêuticas não são bem compreendidas. Avaliamos o impacto subagudo da psilocibina na função cerebral em dois ensaios clínicos de depressão. O primeiro foi um ensaio aberto de psilocibina administrada por via oral (10 mg e 25 mg, 7 dias de intervalo) em pacientes com depressão resistente ao tratamento. A ressonância magnética funcional (fMRI) foi registrada no início e 1 d após a dose de 25 mg. O inventário de depressão de Beck foi o desfecho primário ( MR/J00460X/1). O segundo estudo foi um estudo randomizado controlado duplo-cego de fase II comparando a terapia com psilocibina com escitalopram. Os pacientes com transtorno depressivo maior receberam 2 × 25 mg de psilocibina oral, com 3 semanas de intervalo, mais 6 semanas de placebo diário ('braço da psilocibina') ou 2 × 1 mg de psilocibina oral, com 3 semanas de intervalo, mais 6 semanas de escitalopram diário (10 –20 mg) ('braço escitalopram'). fMRI foi registrado no início e 3 semanas após a segunda dose de psilocibina ( NCT03429075). Em ambos os ensaios, a resposta antidepressiva à psilocibina foi rápida, sustentada e correlacionada com reduções na modularidade da rede cerebral fMRI, implicando que a ação antidepressiva da psilocibina pode depender de um aumento global na integração da rede cerebral. As análises de cartografia de rede indicaram que as redes funcionais de ordem superior ricas em receptores 5-HT2A tornaram-se mais funcionalmente interconectadas e flexíveis após o tratamento com psilocibina. A resposta antidepressiva ao escitalopram foi mais branda e não foram observadas alterações na organização da rede cerebral. Alterações cerebrais consistentes relacionadas à eficácia, correlacionadas com efeitos antidepressivos robustos em dois estudos, sugerem um mecanismo antidepressivo para a terapia com psilocibina: aumentos globais na integração da rede cerebral.
Principal
A depressão é uma condição de saúde mental altamente prevalente 1 , cuja incidência aumentou durante a pandemia de COVID-19 2 , por exemplo, conforme refletido no aumento das prescrições de medicamentos antidepressivos 3 . No entanto, mesmo os antidepressivos de melhor desempenho apresentam eficácia modesta, efeitos colaterais não desprezíveis, problemas de descontinuação e altas taxas de recaída 4 , 5 , 6 , 7 , destacando a necessidade de novos tratamentos aprimorados 8 .
Pacientes com diagnóstico de depressão frequentemente apresentam um viés cognitivo negativo, caracterizado por pessimismo, baixa flexibilidade cognitiva, padrões rígidos de pensamento e fixações negativas em relação ao 'eu' e ao futuro 9 , 10 . Vários autores se inspiraram direta ou indiretamente na teoria dos sistemas dinâmicos para descrever os episódios depressivos como 'estados atratores' (estados cognitivos estereotipados com 'atração gravitacional' 11 ).
A pesquisa de neuroimagem encontrou consistentemente exemplos de funcionamento anormal do cérebro na depressão, ressonantes com sua fenomenologia 12 , 13 , 14 . Uma rede cerebral intrínseca hierarquicamente supraordenada 15 , a rede de modo padrão (DMN), está associada à introspecção e ao pensamento autorreferencial 16 . Essas funções cognitivas são frequentemente hiperativas na depressão 9 , e vários estudos relacionaram o envolvimento excessivo do funcionamento do DMN com a sintomatologia depressiva 12 .
Além do DMN, outras redes cerebrais de ordem superior, como a rede executiva (EN) e a rede de saliência (SN), têm sido implicadas na depressão 14 , 17 . Essas redes estão associadas ao 'controle cognitivo' e à troca de atenção interna versus externa 18 , 19 , 20 . Essa mudança de atenção é frequentemente prejudicada na depressão 21 . Notavelmente, o subtipo do receptor de serotonina 2A (5-HT2A), que é o principal local de ligação proteômica das drogas psicodélicas serotoninérgicas 'clássicas', como a psilocibina 22 , é mais densamente expresso em um amplo padrão de córtex que se assemelha a um mapa de conjunção de DMN, EN e SN 23, correspondendo à porção transmodal do gradiente hierárquico principal do cérebro 15 .
Nos últimos 15 anos, pelo menos seis ensaios clínicos separados relataram melhorias impressionantes nos sintomas depressivos com a terapia com psilocibina 24 . Incluídos entre esses estudos estão (1) um estudo aberto em depressão resistente ao tratamento 25 e (2) um estudo randomizado controlado duplo-cego (DB-RCT) com um comparador ativo, o inibidor seletivo de recaptação de serotonina (ISRS) e antidepressivo convencional, escitalopram 26 . Esses dois ensaios, que incluíram fMRI pré-tratamento e pós-tratamento, são o foco das análises deste artigo.
A ação terapêutica da psilocibina e psicodélicos relacionados não é totalmente compreendida; no entanto, um modelo propõe que os psicodélicos causam uma desregulação induzida pelo receptor 5-HT2A da atividade neuronal espontânea no nível da população, ligada a uma "desintegração" temporária das redes cerebrais funcionais intrínsecas 27 e uma diminuição hipotética na ponderação de precisão dos modelos preditivos codificados (pelo menos em parte) pela integridade dos módulos funcionais 28 . Um corolário importante da "desintegração" modular parece ser a ampliação do repertório funcional de estados do cérebro, compatível com uma paisagem energética global mais ampla ou plana 29 .
Aqui, levantamos a hipótese de que o achado bem replicado da desintegração e dessegregação da rede cerebral sob psicodélicos 30 , 31 será aparente de forma subaguda, em dados de fMRI em estado de repouso pós-tratamento. Também levantamos a hipótese de que esse efeito, consistente com uma paisagem de energia mais plana, estará relacionado a melhores resultados de depressão e não será observado após um curso de ISRS, escitalopram.
Resultados
Teste aberto
Efeito antidepressivo rápido da terapia com psilocibina
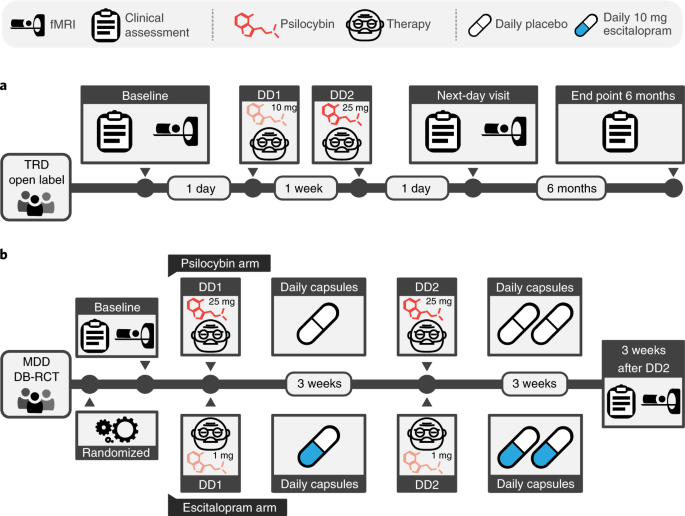
Pacientes com depressão resistente ao tratamento (TRD) participaram de um estudo clínico aberto de terapia com psilocibina de braço único (Fig. 1a ). A avaliação clínica inicial e fMRI em estado de repouso foram seguidas por dias de dosagem (DDs) de terapia de psilocibina 'baixo' (10 mg) e 'alto' (25 mg) de ordem fixa que foram separados por 1 semana. Uma segunda avaliação clínica e fMRI foram realizadas 1 d após DD2. Avaliações remotas do estado clínico foram realizadas 1 semana, 3 meses e 6 meses após DD2. Mais detalhes estão disponíveis em Métodos e em outros lugares 25 .
a , Ensaio aberto. Os pacientes elegíveis compareceram a uma avaliação clínica inicial e a uma visita de fMRI em estado de repouso. Isso foi seguido por dois DDs de terapia com psilocibina administrados oralmente separados por 1 semana, que diferiram na força da dose (10 mg em DD1, 25 mg em DD2). A varredura fMRI pós-tratamento ocorreu 1 d após DD2. A avaliação clínica remota continuou por 6 meses. b, DB-RCT. Os pacientes compareceram a uma avaliação clínica inicial e a uma visita de fMRI em estado de repouso e foram aleatoriamente designados para o braço da psilocibina (topo) ou braço do escitalopram (parte inferior). O braço da psilocibina envolveu 2 × 25 mg de terapia com psilocibina DDs com 3 semanas de cápsulas diárias de placebo após cada DD. O braço de escitalopram envolveu 2 × 1 mg de terapia com psilocibina DDs com 3 semanas de 10 mg diários de escitalopram após DD1 e 20 mg de escitalopram após DD2. Ambos os grupos participaram de uma avaliação clínica pós-tratamento e visita de fMRI 3 semanas e 1 d após DD2.
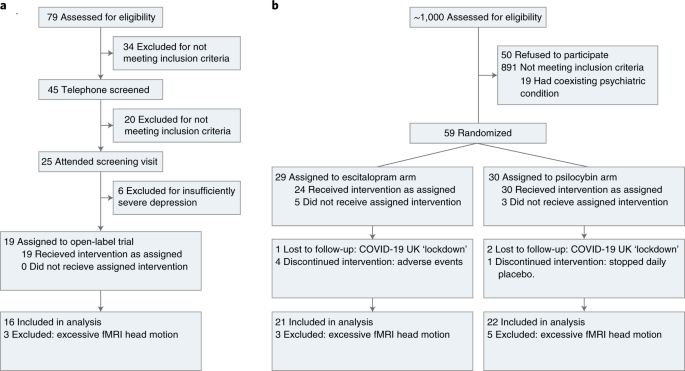
Dos 19 pacientes recrutados, 3 foram excluídos devido ao movimento excessivo da cabeça na fMRI (Fig. 2a ). Nós primeiro confirmamos um efeito antidepressivo da psilocibina nesta amostra de imagem de 16 pacientes (idade média, 42,75 anos, dp = 10,15, 4 mulheres) usando o Inventário de Depressão de Beck (BDI-1A). Esta medida avaliada pelo paciente foi pré-registrada para a investigação original (gtr.ukri.org MR/J00460X/1 ). O BDI captura uma ampla gama de sintomas e coloca ênfase particular nas características cognitivas da depressão 32 , que podem ser um alvo importante da terapia com psilocibina.
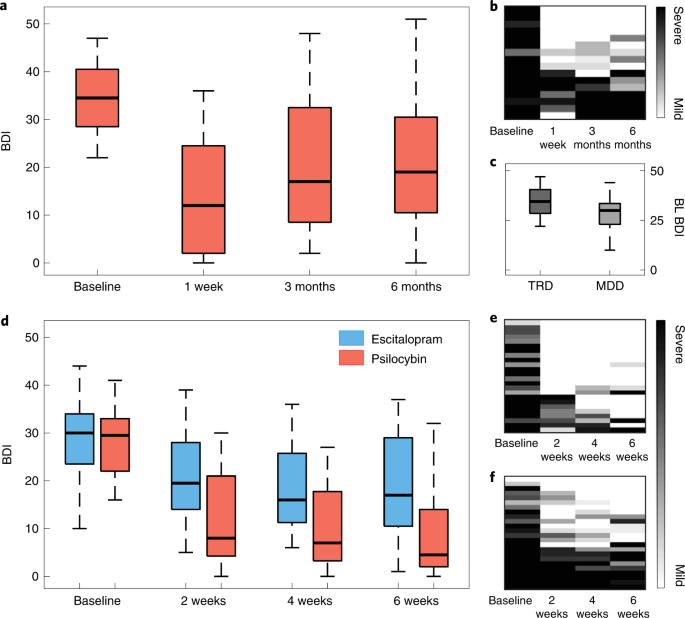
Os escores iniciais do BDI indicaram depressão grave (média do BDI = 34,81, DP = 7,38). De acordo com nosso relatório anterior 25 , reduções rápidas, substanciais e sustentadas na gravidade da depressão foram observadas após o tratamento (Fig. 3a,b ). Em relação à linha de base, reduções significativas de BDI foram observadas em 1 semana (diferença média, −21,0 pontos; t 15 = 7,11, intervalo de confiança de 95% (IC) −27,30 a −14,71, P < 0,001, d de Cohen = 1,78) e ainda evidente aos 6 meses (diferença média, −14,19 pontos; t 15 = 4,26, IC 95% −21,29 a −7,09, P < 0,001, d = 1,07).
a , Gráficos de caixa de ensaio aberto de pontuações BDI de pacientes com TRD em pontos de tempo. b , Gráficos raster qualitativos da pontuação BDI do paciente individual para cada ponto de tempo (colunas). c , BDI basal de pacientes com TRD no ensaio aberto foi significativamente maior do que em pacientes com MDD no DB-RCT ( t 57 = 3,01, IC 95% 2,18 a 10,88, P = 0,013, d = 0,83) . d , pontuações DB-RCT BDI de cada braço de estudo e ponto de tempo. e , f , Gráficos raster qualitativos do BDI de cada paciente para cada ponto de tempo para o braço da psilocibina ( e ) e braço do escitalopram ( f). As marcas centrais do gráfico de caixa representam a mediana do grupo, as bordas da caixa representam os percentis 25 a 75 e os bigodes se estendem ao intervalo de dados. Amostras independentes de n = 16 TRD foram usadas em a e ao lado de n = 43 MDD em c , das quais n = 21 no braço escitalopram e n = 22 no braço psilocibina são exibidos em d . As linhas de cada gráfico raster qualitativo foram ordenadas pela soma da pontuação BDI em pontos de tempo.
Modularidade cerebral diminuída um dia após a terapia com psilocibina
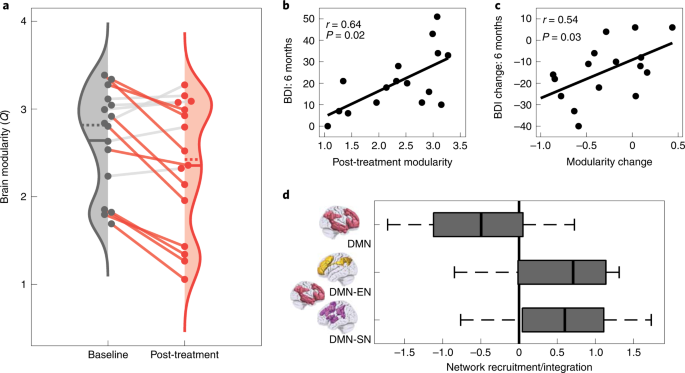
Para testar nossa hipótese primária, dados de fMRI pré-processados foram usados para estimar a modularidade de rede normalizada a partir das matrizes de conectividade funcional de correlação de Pearson do córtex ( Métodos ). Confirmando nossa hipótese primária, a modularidade da rede cerebral foi significativamente reduzida (Fig. 4a ) 1 d após a terapia com psilocibina (diferença média, -0,29; t 15 = 2,87, IC 95% 0,07 a 0,50, P = 0,012, d = 0,72). Este resultado implica um aumento global na conectividade funcional entre as principais redes intrínsecas do cérebro.
a , modularidade cerebral ( Q normalizado ) significativamente reduzida, indicando um aumento global na integração da rede cerebral após terapia com psilocibina em pacientes com TRD ( t 15 = 2,87, IC 95% 0,07 a 0,50, P = 0,012, d = 0,72). As linhas sólidas e pontilhadas representam a média e a mediana, respectivamente. Os dados do paciente são conectados por linhas sólidas e renderizados em cores se a modularidade diminuir. b , A modularidade absoluta do exame pós-tratamento correlacionou-se com os escores absolutos do BDI no desfecho primário de 6 meses ( r 14 = 0,64, IC 95% 0,29 a 0,84, P = 0,023, FDR corrigido). c, A mudança pós-tratamento na modularidade do cérebro correlacionou-se significativamente com a resposta ao tratamento (BDI, linha de base − 6 meses) ( r 14 = 0,54, IC 95% 0,14 a 0,78, P = 0,033). d , DMN (vermelho) recrutamento diminuiu ( t 15 = −2,99, 95% CI −0,92 a −0,15, P = 0,009, d = 0,75) e sua integração entre redes com o EN (ouro) ( t 15 = 3,01, 95% CI 0,15 a 0,90, P = 0,01, d = 0,75) e SN (roxo) ( t 15 = 2,89, 95% CI 0,14 a 0,95, P = 0,01, d = 0,72) aumentou após a terapia com psilocibina (todos corrigidos por FDR). As marcas centrais do gráfico de caixa representam a mediana do grupo, as bordas da caixa representam os percentis 25 a 75 e os bigodes se estendem ao intervalo de dados. Amostras independentes de n = 16 TRD foram usadas em a – d .
A diminuição da modularidade prevê melhores resultados clínicos
Nossa hipótese é que a diminuição da modularidade da rede cerebral estaria relacionada às melhorias sustentadas na gravidade da depressão que seguem a terapia com psilocibina. Para testar isso, calculamos as correlações de Pearson entre a modularidade cerebral pós-tratamento e os escores BDI dos três pontos de tempo pós-tratamento (1 semana, 3 meses, 6 meses). Após a correção da taxa de descoberta falsa (FDR) para comparações múltiplas, uma forte correlação significativa de Pearson foi observada no ponto final primário de 6 meses ( r 14 = 0,64, 95% CI 0,29 a 0,84, P = 0,023; Fig. 4b ). Relações direcionalmente consistentes foram observadas em 3 meses ( r 14 = 0,46, 95% CI 0,03 a 0,74, P = 0,114) e 1 semana ( r14 = 0,29, IC 95% −0,16 a 0,64, P = 0,284), mas estes não sobreviveram à correção. As alterações pré-tratamento versus pós-tratamento na modularidade correlacionaram-se significativamente com a alteração na pontuação do BDI em 6 meses, em relação à linha de base ( r 14 = 0,54, IC 95% 0,14 a 0,78, P = 0,033; Fig. 4c ). Esses resultados implicam que a diminuição da modularidade cerebral 1 d após a terapia com psilocibina está relacionada a melhorias de longo prazo na gravidade dos sintomas de depressão.
Alterações na DMN na conectividade funcional dentro da rede e entre redes um dia após o tratamento
Pesquisas anteriores implicaram sintomatologia depressiva com hiperconectividade da DMN 12 e hipoconectividade da DMN com outras redes 'cognitivas' de ordem superior, incluindo EN e SN 14 , 17 . Portanto, testamos a evidência dessas anormalidades sendo atenuadas após o tratamento usando cartografia funcional ( Métodos ). Consistente com nossa hipótese anterior, reduções significativas no recrutamento da rede DMN (diferença média, −0,54; t 15 = −2,99, 95% CI −0,92 a −0,15, P = 0,009, d = 0,75; Fig. 4d ) e aumento entre- integração de rede entre DMN e EN (diferença média, 0,53; t15 = 3,01, 95% CI 0,15 a 0,90, P = 0,01, d = 0,75) e entre DMN e SN (diferença média, 0,55; t 15 = 2,89, 95% CI 0,14 a 0,95, P = 0,01, d = 0,72 ; FDR-corrigido) foram observados 1 d após a terapia com psilocibina. Uma análise exploratória das mudanças no recrutamento de rede e integração entre redes de outras redes cerebrais está disponível na Fig. 2 Suplementar .
Tomados em conjunto, esses achados indicam uma diminuição clinicamente relevante na modularidade da rede cerebral após a terapia com psilocibina para TRD. Uma análise da cartografia da rede sugere que essa mudança global na organização da rede pode ser sustentada por uma diminuição específica na conectividade dentro da DMN e aumento na conectividade da DMN com outras redes de ordem superior, incluindo a EN e a SN.
Ensaio controlado randomizado duplo-cego
Terapia com psilocibina versus escitalopram para depressão
O desenho deste DB-RCT (Fig. 1b ) deu uma nova oportunidade para comparar não apenas a segurança e a eficácia, mas também os mecanismos de ação da terapia com psilocibina aos de um medicamento antidepressivo convencional, o escitalopram. Pacientes com transtorno depressivo maior (MDD) foram alocados aleatoriamente para um 'braço de psilocibina' ou 'braço de escitalopram' (Fig. 1b). A avaliação clínica inicial e a fMRI em estado de repouso foram seguidas por DD1, quando os pacientes receberam 25 mg de psilocibina (braço de psilocibina) ou uma dose inativa presumida de 1 mg de psilocibina (braço de escitalopram). Todos os pacientes foram informados de que receberiam psilocibina, mas desconheciam a dosagem. DD2 ocorreu 3 semanas após DD1 e foi uma dosagem duplicada. Começando 1 d após DD1, os pacientes tomaram cápsulas diárias por 6 semanas e 1 d no total. Para ambas as condições, uma cápsula por dia foi ingerida nas primeiras 3 semanas e duas cápsulas por dia foram ingeridas a partir de então. O conteúdo da cápsula era placebo inerte (celulose microcristalina no braço da psilocibina) ou 10 mg de escitalopram no braço do escitalopram (10 mg diariamente nas primeiras 3 semanas e 2 × 10 mg (20 mg) diariamente nos últimos 22 dias). Mais detalhes estão disponíveis em Métodose em outros lugares 26 .
Dos 59 pacientes com TDM recrutados, 29 foram alocados aleatoriamente para o braço do escitalopram. Desses, quatro descontinuaram devido a reações adversas ao escitalopram, um foi perdido devido ao bloqueio do COVID-19 no Reino Unido e três foram excluídos devido ao movimento excessivo da cabeça de fMRI (Fig. 2b ) . Os 21 pacientes restantes (média de idade, 40,9 anos, dp = 10,1, 6 mulheres) foram incluídos na amostra de imagem do escitalopram. Trinta pacientes foram alocados aleatoriamente para o braço psilocibina. Destes, um foi excluído por optar por não tomar as cápsulas diárias (placebo), dois não compareceram à sessão pós-tratamento devido ao bloqueio do COVID-19 no Reino Unido e cinco foram excluídos devido ao movimento excessivo da cabeça de fMRI. Os 22 pacientes restantes (idade média, 44,5 anos, sd = 11,0, 8 mulheres) foram incluídos na amostra de imagens de psilocibina (Fig. 2b).
O BDI foi uma medida de resultado primário para o ensaio aberto ( MR/J00440/1 ) e uma medida de resultado secundário para este DB-RCT (identificador de ClinicalTrials.gov NCT03429075 ); no entanto, essa medida provou ser um índice especialmente sensível de reduções pós-psilocibina na gravidade dos sintomas em todos os ensaios 26 . Entre os ensaios, o BDI basal (Fig. 3c ) foi significativamente maior no ensaio aberto TRD em comparação com o ensaio DB-RCT MDD (diferença média, 6,53 pontos; t 57 = 3,01, IC 95% 2,18 a 10,88, P = 0, 013, d = 0,83). Essa diferença provavelmente se deve ao TRD ser um critério de inclusão no ensaio aberto, mas não neste DB-RCT.
Conforme descrito em nosso relatório anterior 26 , as reduções medidas pelo BDI na gravidade dos sintomas depressivos foram significativamente maiores após psilocibina do que escitalopram, indicando eficácia superior da terapia com psilocibina versus escitalopram (Fig. 3d ). Além disso, confirmamos a significância estatística desse contraste dentro da amostra menor de neuroimagem incluída nas presentes análises após testar uma análise de braço × ponto de tempo da interação de variância nos escores BDI ( F 3,123 , 4,47; P = 0,005). As comparações pareadas corrigidas por FDR em relação à linha de base foram significativamente diferentes em 2 semanas (diferença média, −8,73; t 41 = −3,66, IC de 95% −13,55 a −3,91, P = 0,002,d = 0,98), 4 semanas (diferença média, −7,79; t 41 = −2,69, 95% CI −13,62 a −1,95, P = 0,013, d = 0,77) e em 6 semanas (diferença média, −8,78; t 41 = −2,61, 95% CI = −15,58 a −1,97, P = 0,013, d = 0,75), todos favorecendo o braço da psilocibina.
Modularidade cerebral diminuída para psilocibina, mas não para escitalopram
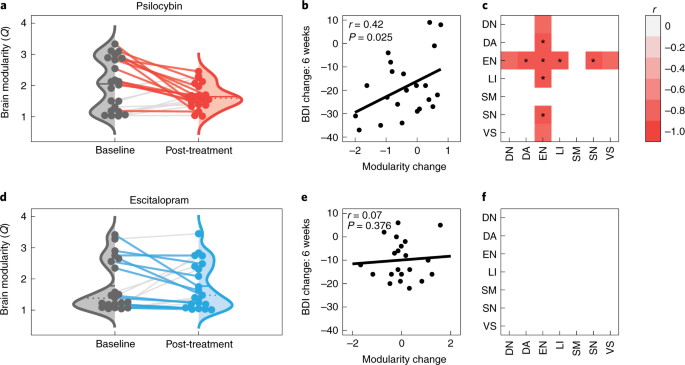
Reconfirmando nossa hipótese primária (Fig. 5a,b ) e replicando as análises nos dados do estudo aberto, a modularidade da rede cerebral foi significativamente reduzida no ponto final primário do estudo, 3 semanas após a terapia com psilocibina (diferença média, -0,39; t 21 = −2,20, 95% CI −0,75 a −0,02, P = 0,039, d = 0,47). Além disso, para a condição de psilocibina, as reduções pós-tratamento na modularidade da rede cerebral correlacionaram-se significativamente com melhorias na gravidade dos sintomas de depressão neste ponto final primário ( r 20 = 0,42, P = 0,025, unicaudal).
a , Diminuições significativas na modularidade da rede cerebral ( Q normalizado ), indicando maior integração da rede cerebral após a terapia com psilocibina ( t 21 = −2,20, 95% CI −0,75 a −0,02, P = 0,039, d = 0,47). As linhas sólidas e pontilhadas nas distribuições representam a média e a mediana, respectivamente. Os dados individuais do paciente são representados e conectados com linhas sólidas entre as sessões que são renderizadas com cores se a modularidade diminuir entre as sessões. b , A mudança pós-tratamento na modularidade do cérebro correlacionou-se significativamente com o ponto final primário da resposta ao tratamento (BDI, linha de base − 6 semanas) ( r 20 = 0,42, P = 0,025, unicaudal). c , As correlações significativas entre o aumento da flexibilidade da rede dinâmica e a resposta ao tratamento do ponto final primário da psilocibina (BDI, linha de base − 6 semanas) são coloridas (branco, P > 0,05; *sobrevive à correção do FDR). O EN exibiu a maior correlação ( r 20 = −0,76, IC 95% −0,90 a −0,50, P = 0,001). d – f , As análises equivalentes da modularidade da rede cerebral no braço do escitalopram não mostraram diferenças significativas na sessão ( d ), relação com a resposta individual ao tratamento ( e ) ou flexibilidade da rede ( f ). n = 22 amostras independentes do braço de psilocibina são exibidas em a – c e n = 21 amostras independentes do braço de escitalopram são exibidas em d – f . DN, rede de modo padrão; DA, atenção dorsal; EN, rede executiva; LI, límbico; SM, somatomotor; SN, rede de saliência; VS, visual.
Notavelmente, não houve interação significativa entre o braço de tratamento e a sessão de escaneamento na modularidade da rede ( F 1,41 = 2,719, P = 0,107); no entanto, houve evidências de que a redução na modularidade da rede e sua relação com a gravidade da depressão podem ser específicas do braço da psilocibina. Ou seja, no grupo escitalopram (Fig. 5d,e ), a modularidade da rede não mudou desde o início (diferença média, 0,01; t 20 = 0,07, 95% CI −0,35 a 0,33, P = 0,95, d = 0,02) e não não houve correlação significativa entre mudanças na modularidade e mudanças nas pontuações do BDI ( r 19 = 0,08; P = 0,361, unicaudal).
A resposta à psilocibina se correlaciona com a flexibilidade da rede
As mudanças específicas no recrutamento da rede observadas 1 d após a terapia com psilocibina no ensaio aberto não foram replicadas em 3 semanas neste DB-RCT ( Informações Suplementares ). No entanto, o protocolo de varredura fMRI mais rápido adotado no DB-RCT gerou o dobro de dados temporais por sessão de varredura ( Métodos ). Isso forneceu a rara oportunidade de examinar mudanças na flexibilidade dinâmica das redes cerebrais após a terapia com psilocibina.
A métrica conhecida como 'flexibilidade dinâmica' indica a frequência com que as regiões do cérebro mudam sua lealdade à comunidade ao longo do tempo, durante o curso de uma ressonância magnética funcional 33 , 34 ( Métodos ). A dinâmica funcional reduzida já foi previamente associada à sintomatologia depressiva 14 . Em uma análise exploratória, as alterações pós-psilocibina na flexibilidade da rede foram correlacionadas com as alterações na pontuação do BDI (Fig. 5c ). Após a correção do FDR, o aumento da flexibilidade dinâmica do EN correlacionou-se fortemente com maior melhora dos sintomas no ponto final primário de 6 semanas para o braço da psilocibina ( r 20 = −0,76, 95% CI −0,90 a −0,50, P = 0,001). Correlações fortes que sobreviveram à correção FDR também foram observadas ao combinar regiões do EN com outras redes frontoparietais laterais, como o SN e a rede de atenção dorsal (Fig. 5c ). Criticamente, não houve correlações significativas entre as alterações nas pontuações do BDI e as alterações na flexibilidade dinâmica no braço do escitalopram (Fig. 5f ).
Discussão
À luz das crescentes evidências da eficácia antidepressiva da terapia com psilocibina 26 , os presentes achados avançam nossa compreensão de seus possíveis mecanismos cerebrais subjacentes. Em dois ensaios, a diminuição da modularidade cerebral foi observada e correlacionada com melhorias na sintomatologia depressiva. Além disso, essa ação antidepressiva pode ser específica da terapia com psilocibina, pois não foram observadas alterações na modularidade com o antidepressivo SSRI convencional, escitalopram.
A pesquisa sobre a ação cerebral aguda dos psicodélicos revelou mudanças bem replicadas na função cerebral global que são um tanto consistentes com as observadas aqui (um repertório aumentado de conectividade funcional (FC) inter-regional e entre redes 29 , 30 , 31 ) . Uma análise anterior nossa sugeriu algumas mudanças contrastantes na arquitetura da função cerebral espontânea 1 d após o tratamento com psilocibina para depressão em relação ao que foi observado durante o próprio estado psicodélico agudo: DMN FC expandido espacialmente (1 d após o tratamento para TRD) versus "desintegração" aguda da DMN 25 . No entanto, outros relataram evidências de aumento da CF inter-rede 1 semana e 1 mês após o tratamento com psilocibina 35, bem como 1 d após a ayahuasca, incluindo aumentos na FC DMN-SN em voluntários saudáveis 36 . Essas descobertas são consistentes com o presente estudo, mas aqui mostramos evidências robustas e confiáveis de que o aumento da integração global da rede cerebral acompanha a eficácia antidepressiva da terapia com psilocibina.
As atuais métricas de modularidade podem ser índices mais sensíveis da ação antidepressiva da psilocibina do que as análises FC de tempo médio intra-rede e entre-redes previamente aplicadas 25 . De fato, eles podem ter relevância para outras métricas de CF aplicadas a dados de fMRI psicodélicos de estado agudo 29 , 30 onde surgiu uma imagem geral de FC global aumentada e um espaço de estado dinâmico ampliado 28. Nesse contexto, os resultados poderiam ser entendidos como um efeito de 'transição' semelhante à dinâmica cerebral associada à ação aguda de psicodélicos, embora em nível atenuado e em uma população específica (pacientes deprimidos). Para mostrar robustez ao método analítico, também realizamos análises univariadas de massa mais tradicionais e estas produziram resultados consistentes (Figs. Complementares 3 e 4 ). No entanto, uma vantagem da modularidade da rede é sua capacidade de resumir elegantemente as mudanças globais na organização da rede funcional do cérebro 37 .
Pesquisas anteriores sobre a atividade em estado de repouso na depressão encontraram modularidade de rede elevada correlacionada com a gravidade dos sintomas 17 , 38 . Trabalhos adicionais implicam aumento da CF intra-DMN e FC elevada entre regiões límbicas, como a amígdala, e regiões corticais de alto nível correlacionam-se com sintomas ruminativos na depressão 12 , 39 . Tomados em conjunto, surge um modelo de função cerebral espontânea anormalmente modular na depressão que é efetivamente remediada pela terapia com psilocibina. De acordo com várias descobertas, a paisagem de energia FC ou espaço de estado na depressão pode ser descrito como anormalmente restrito, em paralelo com a qualidade ruminativa estreita, focada internamente, do humor e da cognição no distúrbio 11. Em contraste, a psilocibina parece aumentar a capacidade do cérebro de visitar um espaço de estado mais amplo, tanto agudamente quanto após a terapia com psilocibina em pacientes deprimidos, como mostrado aqui. Além disso, esta ação 'libertadora' da psilocibina é acompanhada por relatos subjetivos de 'liberação emocional' 40 , 41 bem como aumentos subagudos no otimismo comportamental 9 , flexibilidade cognitiva 42 e flexibilidade psicológica após tomar uma droga psicodélica 43 . De fato, a responsividade emocional aumentada pode ser específica da terapia com psilocibina versus ISRSs 26 .
É plausível que esse suposto efeito libertador da psilocibina na atividade cortical ocorra por meio de sua ação agonista direta nos receptores 5-HT2A corticais, desregulando a atividade em regiões ricas em sua expressão. Supomos que o escitalopram crônico não tenha o mesmo efeito sobre a modularidade cerebral devido à sua ação mais generalizada no sistema serotoninérgico e ação predominante nos receptores inibitórios pós-sinápticos 5-HT1A, que são ricamente expressos no circuito límbico 27 , 44 .
Além da diminuição global na modularidade da rede após a psilocibina, observamos mudanças funcionais na dinâmica DMN, EN e SN que são consistentes com modelos neurobiológicos de depressão 45 . Essas redes transmodais de alta ordem abrigam a maior densidade de receptores 5-HT2A, o principal local de ação dos psicodélicos serotoninérgicos 22 , 23 . As redes de ordem superior estão implicadas na ação aguda dos psicodélicos, onde apresentam modularidade reduzida e aumento da comunicação com regiões normalmente fora dos limites de suas comunidades 29 , 30 , 31 .
O EN e o SN têm sido associados a tarefas que requerem flexibilidade cognitiva, como aprendizado e troca de tarefas 18 , 19 , 46 , 47 ; O funcionamento prejudicado dessas redes foi relatado na depressão 14 , 17 e em outros transtornos que exibem inflexibilidade cognitiva, como transtorno do espectro autista 48 e transtorno obsessivo-compulsivo 49. Nossos resultados sugerem que a modularidade diminuída ou o aumento da flexibilidade dessas redes após a terapia com psilocibina é um componente chave de seu mecanismo de ação terapêutico. Não avaliamos formalmente a flexibilidade cognitiva nos ensaios clínicos relatados aqui, mas observamos melhorias no funcionamento cognitivo geral após o tratamento com psilocibina no DB-RCT, bem como melhorias específicas do tratamento em 'evitação emocional' (uma inversão do construto relacionado 'flexibilidade psicológica' 26 ).
Deve-se notar que os processos psicológicos que não se relacionam de forma confiável com as alterações da modularidade cerebral podem ter desempenhado um papel nos principais resultados clínicos deste estudo, e a incapacidade de descartar tais fatores impede a realização de inferências confiáveis de que a droga sozinha foi o principal fator causal. determinante dos resultados de imagem ou, de fato, que a modularidade diminuída é suficiente para a resposta à terapia com psilocibina. No entanto, as mudanças observadas nos dados de neuroimagem foram consistentes com pesquisas anteriores de imagens cerebrais sobre a ação aguda de psicodélicos e são plausíveis à luz da evidência de modularidade elevada e funcionamento anormal de redes de ordem superior na depressão 12 , 17 , 38 , 39 , 50 .
Os DB-RCTs de fase III bem-sucedidos serão necessários para obter o licenciamento para a terapia com psilocibina, mas os ensaios pragmáticos podem abordar melhor as questões relacionadas à praticabilidade, especificidade e otimização do tratamento 51 . Dada a pesquisa emergente sobre a terapia psicodélica, é importante que os ensaios em larga escala estabeleçam a generalização, confiabilidade e especificidade da resposta antidepressiva da psilocibina. Por exemplo, é provável que a eficácia dependa da gravidade dos sintomas, subtipos de depressão e comorbidades, bem como de outros fatores farmacológicos e extrafarmacológicos importantes 52. Para estudos de imagens cerebrais, recomendamos análises de modularidade de rede, como as empregadas aqui. Conjuntos de dados fMRI são complexos, onerosos e suscetíveis a ruídos, contribuindo para o desafio de detectar biomarcadores confiáveis. A simplificação de medidas compostas, como modularidade de rede, combinada com um domínio de pesquisa, abordagem baseada em sintomas para fenômenos psicológicos, pode ser um caminho particularmente produtivo a seguir 37 , 51 .
Deve-se notar que os achados do presente estudo não suportam a modularidade da linha de base como um preditor de resposta à terapia com psilocibina. Pacientes com uma gama de valores de modularidade de linha de base mostraram reduções de modularidade após o tratamento com psilocibina; no entanto, os presentes resultados sugerem que a mudança de modularidade da fase inicial é preditiva da resposta do tratamento a longo prazo à terapia com psilocibina.
É importante considerar os efeitos potencialmente confusos do movimento da cabeça ao interpretar os dados da fMRI. Aqui, um pipeline robusto de pré-processamento de fMRI foi empregado juntamente com critérios estritos de movimento da cabeça para a inclusão do paciente. Para examinar a robustez ao movimento, uma análise do movimento da cabeça foi realizada e está disponível nas Informações Suplementares . Essas análises reforçam os achados atuais, pois não há evidências de que o movimento da cabeça seja diferente entre as sessões ou braços de tratamento ou que esteja correlacionado com a modularidade da rede. Os dados de fMRI foram coletados com um protocolo de olhos fechados, que apresenta algumas vantagens; no entanto, seria interessante se essas descobertas fossem replicadas em dados adquiridos com um protocolo de olhos abertos. O sono no scanner pode ser mais provável durante fMRI com os olhos fechados, o que é uma desvantagem particular53 . O sono no scanner não pode ser descartado aqui. No entanto, as análises do movimento da cabeça tornam improvável que o sono seja um fator de confusão. Além disso, uma escala analógica visual auto-relatada de tempo gasto dormindo e 'sonolência' foi adquirida imediatamente após todas as varreduras no estudo 2. Uma análise desses dados está disponível nas Informações Suplementares . Criticamente, as classificações de sono ou sonolência no scanner foram baixas e não diferiram entre os braços de tratamento ou a sessão de digitalização.
A hipótese primária deste estudo foi confirmada e replicada apesar das diferenças substanciais entre o desenho dos dois ensaios. A gravidade da depressão basal foi significativamente maior no ensaio aberto. Além disso, a varredura fMRI pós-tratamento de teste aberto foi apenas 1 d após DD2 e foi registrada com uma bobina de cabeça de 12 canais e um tempo de repetição (TR) de 2 s. Em contraste, a varredura pós-tratamento DB-RCT foi realizada 3 semanas após DD2 e foi registrada com uma bobina de cabeça de 32 canais e um TR de 1,25 s.
Reconhecer essas diferenças entre os desenhos dos estudos serve para fortalecer a validade dos principais achados, pois foram replicados de forma robusta; no entanto, a falta de replicação nas análises cartográficas mais refinadas limita as inferências específicas da rede. Uma análise suplementar ( Informações Suplementares ) confirmou que a gravidade da depressão basal se correlacionou com a conectividade dentro da DMN e entre as redes DMN-EN e DMN-SN, conforme relatado anteriormente 12 , 17 , 38 , 39 , 50; no entanto, no DB-RCT, não replicamos a totalidade das mudanças na cartografia da rede que foram observadas no ensaio aberto. Dado que os efeitos de rede observados seguem diretamente as previsões da literatura sobre depressão, pode ser que eles sejam mais pronunciados em casos mais graves, como aqueles incluídos no estudo aberto TRD. Alternativamente, pode ser que esses efeitos sejam detectáveis apenas em uma fase subaguda de curto prazo após a terapia com psilocibina e não, por exemplo, 3 semanas depois. Analisar a contribuição relativa da gravidade da linha de base e do tempo desde o tratamento será uma característica importante de futuros ensaios clínicos com neuroimagem, idealmente com amostras maiores e sessões de varredura repetidas.
As análises dinâmicas podem ser difíceis de conduzir. Para ter energia suficiente, as séries temporais precisam ter comprimento suficiente para serem divididas em várias janelas de tempo suficientemente longas para computar medidas confiáveis de FC, e pesquisas anteriores guiaram nossa seleção de parâmetros 54 , 55 . Coletar dados fMRI suficientes em coortes de pacientes pode ser um desafio, mas devido ao apelo das análises dinâmicas, esforços estão sendo feitos para facilitar e melhorá-las 54 . Deve-se notar que uma janela de tempo suficientemente ampla foi usada para estimar a correlação de Pearson FC; no entanto, é necessário um trabalho contínuo para entender melhor como capturar os dados dinâmicos mais funcionalmente significativos.
Com essas ressalvas inseridas, deve-se enfatizar que as inferências de ambas as análises de cartografia convergiram para as redes de ordem superior do cérebro. Em particular, as análises DB-RCT mostraram correlações robustas ( r ~0,8) entre o aumento da flexibilidade da rede de ordem superior e a resposta ao tratamento da psilocibina, e isso converge com o ensaio aberto, bem como com pesquisas anteriores 14 .
Em resumo, a depressão é um importante problema de saúde pública associado a enormes encargos e custos. Aqui, identificamos um biomarcador robusto, confiável e potencialmente específico de resposta à terapia com psilocibina para depressão. Nossos resultados podem ajudar a explicar por que a terapia com psilocibina é promissora como uma nova opção de tratamento em psiquiatria.
Métodos
Visão geral do teste
Os desenhos dos ensaios (Fig. 1 ) e os principais resultados clínicos dos ensaios abertos 31 (gtr.ukri.org: MR/J00460X/1) e DB-RCT 32 (clinicaltrials.gov: NCT03429075 ) foram publicados anteriormente. Ambos os ensaios foram conduzidos no National Institute for Health Research Imperial Clinical Research Facility e receberam patrocínio do Imperial College London, pesquisa do NHS e aprovação ética do Imperial College Joint Research and Compliance Office, Health Research Authority e Medicines and Healthcare products Regulatory Agency. Este trabalho foi realizado sob uma licença de medicamentos do cronograma 1 do Ministério do Interior do Reino Unido. Todos os participantes forneceram consentimento informado por escrito. Os participantes não foram compensados financeiramente.
participantes
Para ambos os ensaios, a elegibilidade exigia um diagnóstico confirmado por um clínico geral de MDD unipolar (16+ na escala de classificação de depressão de Hamilton de 21 itens). O estudo aberto tinha os critérios adicionais de TRD, conforme definido por nenhuma melhora apesar de vários cursos de medicação antidepressiva (média = 4,6 ± 2,6 medicamentos anteriores; variação, 2-11) 39 . Os pacientes foram questionados se tinham experiência anterior com o uso de psicodélicos. No ensaio aberto, 25% tinham experiência anterior. Da mesma forma, no DB-RCT, 31% dos pacientes no braço da psilocibina e 24% no braço do escitalopram tiveram experiência anterior.
Os critérios de exclusão foram história familiar imediata ou pessoal de psicose, condição de saúde física de risco (avaliada pelo médico), história de tentativas graves de suicídio, teste de gravidez positivo e contra-indicações para ressonância magnética. O DB-RCT teve como critérios adicionais de exclusão as contraindicações de ISRS ou uso prévio de escitalopram. Digno de nota, a resistência ao tratamento não foi um critério de inclusão ou exclusão no DB-RCT. Todos os pacientes elegíveis realizaram entrevistas de triagem por telefone, forneceram consentimento informado por escrito e seus históricos médicos físicos e mentais foram minuciosamente avaliados.
Intervenções
Dezenove pacientes com TRD foram recrutados para o ensaio aberto e participaram de uma sessão inicial de pré-tratamento de 1 dia que incluiu fMRI em estado de repouso com os olhos fechados e avaliação clínica (Fig. 1a ) . Isso foi seguido por dois DDs de terapia com psilocibina, separados por 1 semana. Uma dose baixa de psilocibina (10 mg) foi ingerida por via oral em DD1 e seguida por uma dose alta (25 mg) em DD2. O fMRI de acompanhamento e a avaliação clínica ocorreram 1 d após DD2. Os pacientes compareceram a uma avaliação clínica no local 1 semana após o DD2 e completaram a avaliação clínica eletronicamente em 3 e 6 meses. Dos 19 pacientes com TRD, 16 foram retidos (média de idade, 42,75 anos; dp = 10,15, 4 mulheres) para a presente análise após 3 terem sido excluídos devido ao movimento excessivo da cabeça de fMRI (Fig. 2a ) .
Dos 59 pacientes MDD recrutados para o DB-RCT, um gerador de números aleatórios alocou 30 para o braço psilocibina e 29 para o braço escitalopram (Fig. 1b ). As amostras de imagem finais para esta investigação foram n = 22 para o braço da psilocibina (idade média, 44,5 anos, dp = 11,0, 8 mulheres) e n = 21 para o braço do escitalopram (idade média, 40,9 anos, dp = 10,1, 6 mulheres ) (Fig. 2b). Os pacientes compareceram a uma fMRI em repouso pré-tratamento com os olhos fechados. DD1 consistia em 25 mg de psilocibina (braço de psilocibina) ou uma dose presumida desprezível de 1 mg de psilocibina (braço de escitalopram). Todos os pacientes foram informados de que receberiam psilocibina, mas desconheciam a dosagem. DD2 ocorreu 3 semanas após DD1 e foi uma dosagem duplicada. Não houve cruzamento de dosagem. Começando 1 d após DD1, os pacientes tomaram cápsulas diárias por 6 semanas e 1 d no total. Para ambas as condições, uma cápsula por dia foi ingerida nas primeiras 3 semanas e duas depois disso. O conteúdo da cápsula era placebo inerte (celulose microcristalina no braço da psilocibina) ou escitalopram no braço do escitalopram, 10 mg nas primeiras 3 semanas e 2 × 10 mg (20 mg) no total depois disso.
Medindo a gravidade da depressão
Escores BDI-1A foram usados para avaliar a gravidade da depressão em ambos os estudos. Essa medida avaliada pelo paciente capta uma gama mais ampla de sintomas, com foco adicional nas características cognitivas da depressão, em comparação com outras medidas, como o QIDS-SR-16 (ref. 40 ) . O BDI foi pré-registrado como uma medida de desfecho primário no ensaio aberto (gtr.ukri.org MR/J00460X/1 ) e foi medido no início e 1 semana, 3 meses e 6 meses após DD2. Para o DB-RCT, o BDI foi medido no início e 2, 4 e 6 semanas após DD1. O BDI foi uma medida de resultado secundário para este DB-RCT (ClinicalTrials.gov NCT03429075 ) e foi usado aqui para testar a replicação dos efeitos observados no estudo aberto.
Aquisição de ressonância magnética
A imagem cerebral foi realizada em um 3T Siemens Tim Trio na Invicro. As imagens anatômicas foram adquiridas usando a Alzheimer's Disease Neuroimaging Initiative, Grand Opportunity (ADNI-GO 56 ) parâmetros MPRAGE recomendados (voxels isotrópicos de 1 mm; TR, 2.300 ms; TE, 2,98 ms; 160 cortes sagitais; 256 × 256 no campo plano de visão; ângulo de rotação, 9 graus; largura de banda, 240 Hz por pixel; aceleração GRAPPA, 2).
Em ambos os estudos, os dados de fMRI em estado de repouso com olhos fechados foram coletados com imagens ecoplanares ponderadas em T2* com voxels isotrópicos de 3 mm. No estudo 1, uma bobina de cabeça de 12 canais foi usada para adquirir 240 volumes em aproximadamente 8 min: TR, 2.000 ms; TE, 31 ms; 36 cortes axiais; ângulo de inclinação, 80 graus; largura de banda, 2.298 Hz por pixel; e aceleração GRAPPA, 2). No estudo 2, uma bobina de cabeça de 32 canais foi usada para adquirir 480 volumes em ~10 min: TR, 1.250 ms; TE, 30 ms; 44 cortes axiais; ângulo de inclinação, 70 graus; largura de banda, 2.232 Hz por pixel; e aceleração GRAPPA, 2).
pré-processamento de dados fMRI
Os dados de imagem foram pré-processados por meio de um pipeline interno personalizado composto por ferramentas dos pacotes FMRIB Software Library 57 , Analysis of Functional NeuroImages (AFNI) 58 , Freesurfer 59 e Advanced Normalization Tools 60 . Os pacientes foram excluídos se qualquer varredura de fMRI contivesse > 20% de volumes com um deslocamento framewise > 0,5 mm.
Especificamente, foram realizadas as seguintes etapas de pré-processamento: (1) remoção dos três primeiros volumes; (2) remoção de picos (3dDespike, AFNI); (3) correção do tempo de corte (3dTshift, AFNI); (4) correção de movimento (3dvolreg, AFNI) registrando cada volume no volume mais semelhante, no sentido dos mínimos quadrados, a todos os outros; (5) extração cerebral (BET, FSL); (6) registro de corpo rígido para varreduras anatômicas (BBR, FSL); (7) registro não linear para o cérebro do Instituto Neurológico de Montreal (MNI) de 2 mm (Normalização Simétrica, Ferramentas de Normalização Avançada); (8) depuração, usando um limite de deslocamento framewise de 0,5 mm, os volumes depurados foram substituídos pela média dos volumes vizinhos; (9) largura total de 6 mm na metade da suavização espacial gaussiana máxima (3dBlurInMask, AFNI); (10) filtragem passa-banda de 0,01 a 0,08 Hz (3dFourier, AFNI); (11) de-tendência linear e quadrática (3dDetrend, AFNI) e (12) regressão de incômodo voxelwise com os seis regressores de movimento de realinhamento e três regressores de sinal de tecido (Ventrículos, Freesurfer, erodido no espaço de 2 mm), veias de drenagem (FSL's CSF menos Ventrículos de Freesurfer, erodidos no espaço de 1 mm) e substância branca local (WM) (WM do FSL menos estruturas de substância cinzenta subcortical do Freesurfer, erodidas no espaço de 2 mm). Em relação à regressão local do WM, o 3dLocalstat da AFNI foi usado para calcular a série temporal média do WM local para cada voxel, usando uma esfera de 25 mm de raio centrada em cada voxel. erodida no espaço de 1 mm) e substância branca local (WM) (WM do FSL menos estruturas de substância cinzenta subcortical do Freesurfer, erodidas no espaço de 2 mm). Em relação à regressão local do WM, o 3dLocalstat da AFNI foi usado para calcular a série temporal média do WM local para cada voxel, usando uma esfera de 25 mm de raio centrada em cada voxel. erodida no espaço de 1 mm) e substância branca local (WM) (WM do FSL menos estruturas de substância cinzenta subcortical do Freesurfer, erodidas no espaço de 2 mm). Em relação à regressão local do WM, o 3dLocalstat da AFNI foi usado para calcular a série temporal média do WM local para cada voxel, usando uma esfera de 25 mm de raio centrada em cada voxel.
conectividade funcional
Após o pré-processamento, um atlas funcional foi utilizado para separar o córtex cerebral em 100 regiões de interesse (ROIs) 61 . A FC entre cada par de ROIs foi calculada com um coeficiente de correlação de Pearson entre cada par de 'cursos de tempo' de sinal médio (representando flutuações na atividade neural ao longo do tempo). Isso resultou em uma matriz N × N FC, com cada elemento representando a força da conectividade entre um par de ROIs. Valores positivos foram retidos e transformados por Fisher para escores z . Este procedimento foi repetido independentemente para cada paciente e varredura (basal e pós-tratamento).
Modularidade da rede cerebral
A estrutura da comunidade ou segregação entre as redes funcionais do cérebro foi medida resumindo cada matriz FC com um algoritmo comum de detecção de comunidade semelhante a Louvain 62, onde o objetivo é maximizar a extensão em que as áreas do cérebro podem ser separadas em comunidades ou módulos não sobrepostos. A pontuação da função de qualidade da modularidade, Q 63 , tende a ser alta quando o cérebro exibe uma alta segregação entre suas redes funcionais (como fortes aglomerados de FC dentro de redes/comunidades cerebrais com FC fraca para o resto do cérebro).
Essa abordagem tem sido comumente aplicada a dados de fMRI para caracterizar como a função cerebral se adapta em vários contextos 55 . Aqui, a modularidade, Q 63 , foi definida da maneira padrão por:
onde A ij representa o peso de FC (correlação) entre ROI i e j , γ é o parâmetro livre de resolução estrutural (definido como 1) e é o nulo esperado FC definido com como o FC total em todas as conexões com ROI i c i é a comunidade à qual o ROI i é atribuído, é a função Kronecker δ e é igual a 1 se ROI i e j pertencem à mesma comunidade e 0 caso contrário 64 e\delta \left( {c_i,c_j} \right) é o FC total da rede.
Para permitir comparações válidas entre pacientes e varreduras, os escores de modularidade foram gerados 100 vezes e a partição com o maior escore de modularidade foi normalizada pela modularidade média gerada a partir de 100 matrizes FC reconectadas aleatoriamente (embaralhadas) 65 . Esse procedimento comum foi aplicado para contabilizar as partições não determinísticas e quase degeneradas (soluções com otimização diferente, mas semelhante) geradas pelos algoritmos de Louvain e para contabilizar as pontuações de modularidade relacionadas à soma total de FC dentro da rede 66 . Este processo foi repetido independentemente para cada paciente e varredura.
cartografia funcional
O procedimento de detecção de comunidade gera uma atribuição de comunidade para cada ROI. Usamos esses rótulos para determinar até que ponto os ROIs foram recrutados para a rede funcional à qual eles normalmente 'pertencem', conforme definido por adultos saudáveis (como regiões DMN devem formar comunidades de forma confiável entre si).
Primeiro, criamos uma matriz de lealdade, P 33 , que representa a probabilidade de duas regiões i e j serem atribuídas à mesma comunidade nas 100 iterações do algoritmo de modularidade, definido aqui como:
onde O = 100 como o número de partições. Para cada partição, é igual a 1 se as regiões iej pertencem à mesma comunidade.
Usando a matriz de fidelidade, resumimos a frequência com que os ROIs formaram comunidades com ROIs da mesma rede funcional (recrutamento de rede) ou comunidades formadas com ROIs entre redes diferentes (integração entre redes) nas partições 33 . Essas medidas de cartografia funcional foram então normalizadas em relação aos valores médios de 1.000 atribuições de rede ROI aleatoriamente embaralhadas para explicar as diferenças no número de regiões em cada rede 55 . Finalmente, as pontuações de recrutamento de rede e integração entre redes foram calculadas em nível de rede usando sete redes corticais predefinidas 61 .
Flexibilidade dinâmica
O TR curto usado no protocolo fMRI do estudo 2 gerou aproximadamente o dobro do número de pontos de tempo, e isso proporcionou uma análise adicional da flexibilidade dinâmica. A estimativa de modularidade multicamada 34 foi realizada usando uma matriz N × N × T de 30 janelas deslizantes de volume (37,5 s de tempo real) com 50% de sobreposição. Este tamanho de janela é típico para estimar FC dinâmica com fMRI 54 . Para cada paciente e escaneamento, a modularidade multicamadas, Q ML , foi estimada 100 vezes de cada matriz N × N × T FC por:
onde total da rede multicamada, e é o FC total da camada l, A ijl é o FC entre ROI i e j na camada l, é o FC nulo esperado na camada l. Os dois parâmetros livres γ e ω de resolução estrutural e temporal são usados para dimensionar o número de comunidades e a força das bordas intercamadas, respectivamente. Como é típico para análises de modularidade fMRI, ambos foram definidos como 1 (refs. 33 , 55 ).\frac{{k_{il}k_{jl}}}{{2m_l}}
A estimativa de modularidade multicamada gera uma matriz N × T onde cada elemento representa a atribuição da comunidade de cada ROI em cada camada (janela de tempo). A partir disso, a métrica de flexibilidade, f , pode ser simplesmente calculada como o número de vezes que um ROI muda sua fidelidade à comunidade, dado o número de observações 33 :
Pontuações de flexibilidade próximas a 0 representam ROIs rígidos cuja fidelidade à comunidade é estável ao longo do tempo, pontuações próximas a 1 representam ROIs flexíveis cuja fidelidade à comunidade muda regularmente (altamente flexível). As pontuações de flexibilidade no nível da rede foram definidas pela flexibilidade média dos ROIs atribuídos a determinada rede.
Resumo do relatório
Mais informações sobre o projeto de pesquisa estão disponíveis no Nature Research Reporting Summary vinculado a este artigo.